
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 离子键是阴、阳离子之间的吸引力 | |
| C. | 离子化合物可以含共价键 | |
| D. | 分子间作用力越大,分子越稳定 |
分析 A、化学键存在于分子内,存在于相邻原子之间;
B、阴阳离子之间的相互作用是离子键;
C、氢氧化钾中含有离子键和共价键;
D、分子的稳定性是化学性质;
解答 解:A、化学键存在于分子内,存在于相邻原子之间,不存在分子间,故A错误;
B、阴阳离子之间的相互作用是离子键,这种相互作用既包括吸引力也包括排斥力,故B错误;
C、离子化合物中可能含有共价键,如KOH,故C正确;
D、分子的稳定性是化学性质,而分子间作用力是决定物理性质,故D错误;
故选C.
点评 本题考查了化学键和化合物的关系,根据物质中存在的化学键结合离子化合物、共价化合物的基本概念来分析解答,注意不能根据是否含有金属元素判断离子键,为易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
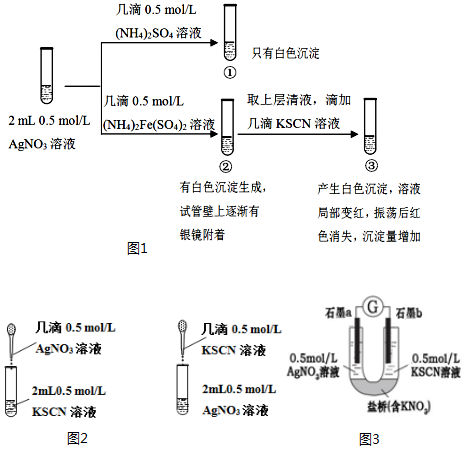
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
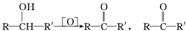 不易被氧化成羧酸
不易被氧化成羧酸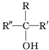 不易被氧化成醛或酮
不易被氧化成醛或酮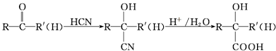
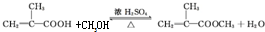 .
. ”结构的共有6种.
”结构的共有6种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用冰水混合物冷却SO3气体;加热I2 | |
| B. | 木炭吸附NO2气体;将Cl2通入品红溶液中 | |
| C. | 打开盛有NO的集气瓶;冷却NO2气体 | |
| D. | 向品红溶液中通入SO2,向FeCl3溶液滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
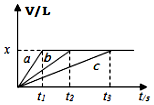 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com