
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
分析 经5min后,测得容器内B的浓度减少了0.2mol/L,则转化的B为5L×0.2mol/L=1mol,则
A(s)+2B(g)?C(g)+2D(g)
开始 2 0 0
转化 1 0.5 1
平衡 1 0.5 1
A.结合v=$\frac{△c}{△t}$计算;
B.结合c=$\frac{n}{V}$计算;
C.该反应为气体体积增大的反应;
D.A为固体,B、C、D为气体.
解答 解:经5min后,测得容器内B的浓度减少了0.2mol/L,则转化的B为5L×0.2mol/L=1mol,则
A(s)+2B(g)?C(g)+2D(g)
开始 2 0 0
转化 1 0.5 1
平衡 1 0.5 1
A.在5min内该反应用C的浓度变化表示的反应速率为$\frac{\frac{0.5mol}{5L}}{5min}$=0.02mol/(L•min),故A错误;
B.5min时,容器内D的浓度为$\frac{1mol}{5L}$=0.2mol/L,故B正确;
C.该反应为气体体积增大的反应,则当容器内压强保持恒定时,该可逆反应达到平衡状态,故C正确;
D.A为固体,B、C、D为气体,则5min时容器内气体总的物质的量为1mol+1mol+0.5mol=2.5mol,故D错误;
故选AD.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、浓度及速率的计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
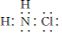 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
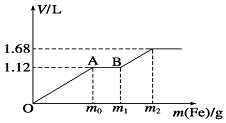 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
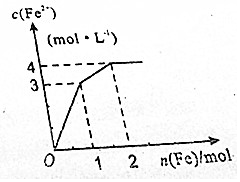 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
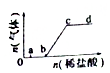 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com