
| A. | 增大反应物浓度 | B. | 加压 | C. | 升温 | D. | 加催化剂 |
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有SO42- | |
| B. | 加入足量的HCl溶液,有气体产生,将气体通入澄清石灰水有白色沉淀.溶液中一定含有CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体且该气体可以使湿润的红色石蕊试纸变蓝.溶液中一定含有NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀.溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
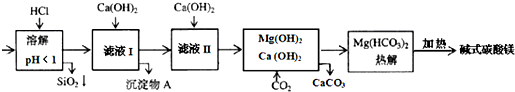
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
| A. | 在滤液I中,加过量的Ca(OH)2使Fe3+和Al3+沉淀完全 | |
| B. | 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全 | |
| C. | 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全 | |
| D. | 若碱式碳酸镁【aMgCO3•b Mg(OH)2】高温加热分解得到6.6g CO2和8.0g MgO,由此可知其化学式为MgCO3•3Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al与NaOH溶液的反应:Al3++3OH-=Al (OH) 3↓ | |
| B. | CaCl2溶液与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2 H+=H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH NaCl KNO3 MgCl2 | B. | NaOH NaCl HCl FeCl3 | ||
| C. | Na2SO4 BaCl2 HCl K2CO3 | D. | Na2CO3 HNO3 HCl Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com