
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.分析 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,判断A为Cl2,A、B、C、D、E都含X元素,B为HClO,D为HCl,C为NaCl,E为NaClO,依据推断出的物质结合物质性质回答问题.
解答 解:依据转化关系图分析,常温下,A是可用来对自来水进行消毒的黄绿色单质气体,判断为Cl2,A、B、C、D、E都含X元素,B为HClO,D为HCl,C为NaCl,E为NaClO;
(1)B为HClO,E为NaClO,故答案为:HClO;NaClO;
(2)反应①为A+NaOH的反应化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;反应②为A+H2O反应的化学方程式为:Cl2+H2O=HCl+HClO;反应③为B光照分解的化学方程式为:2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;Cl2+H2O=HCl+HClO;2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑.
点评 本题考查了物质转化关系的分析应用,氯气及其化合物性质的分析判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 在酸性重铬酸钾溶液中加入少量乙醇:3COH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O | |
| B. | AlCl3•6H2O与SOCl2混合并加热:AlCl3•6H2O+3SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3SO2↑+9HCl | |
| C. | SbCl3水解:SbCl3+H2O?SbOCl+2HCl | |
| D. | 在碘的四氯化碳溶液中加浓的KI溶液:I2+3I-?I3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
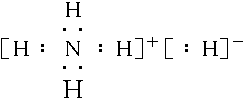 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
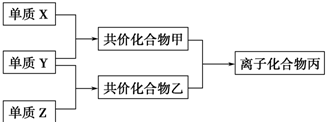
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com