
【题目】CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
【答案】(1)89.6
(2)2.4 mol/L≥c≥1.2 mol/L
(3)![]()
![]() n(H2O)=(9/6)×2=3(mol)
n(H2O)=(9/6)×2=3(mol)
(4)300 mol CH4完全反应产生H2900mol
设CO2转化率为α,CO转化率为β
300β+100α=350 600β+300α=900-120
α=80%
或设CO2转化率为α 900350×2100α=120 α=80/100=80%
【解析】试题分析:
(1)碳酸氢铵分解的化学方程式为:NH4HCO3![]() H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:
①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)= ![]() =1.20mol/L;
=1.20mol/L;
②CO2+2NaOH=Na2CO3+H2O,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)= ![]() =2.40mol/L;
=2.40mol/L;
综合(1)、(2)可知,NaOH溶液的浓度应该为1.20mol/L≤c(NaOH)≤2.40mol/L。
(3)法一:
依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:
8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)= ![]() n(CO2)=
n(CO2)= ![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
法二:
设反应前密封舱内H2O的物质的量为n
4KO2+ 4CO2+ 2H2O → 4KHCO3+ 3O2
2nn 1.5n
4KO2+ 2CO2→ 2K2CO3+ 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。
(4)法一:
CH4+ H2O![]() CO + 3H2
CO + 3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO + 2H2![]() CH3OH CO2+ 3H2
CH3OH CO2+ 3H2![]() CH3OH + H2O
CH3OH + H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120 mol,所以有
600βmol+300αmol="900mol-120" mol--------②式
由①②
法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α
CH4+ H2O![]() CO + 3H2
CO + 3H2
300mol 900mol
CO2+ 3H2![]() CH3OH + H2O
CH3OH + H2O
100αmol 100αmol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120 mol,根据反应中氢元素的守恒可有:900mol-120mol=350mol×2+100αmol,解得α=0.8,即CO2的转化率为80%。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是______(填编号)。
A.可能互为同系物 |
B.在空气中燃烧时火焰明亮且产生黑烟 |
C.一定能使高锰酸钾酸性溶液褪色 |
D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式__________,它的一氯代物的同分异构体有________种。
(3)写出除苯外分子式为C6H6且结构中只有C—C键和C—H键的有机物的结构简式:____________________________________________________________。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使高锰酸钾酸性溶液和溴水褪色,则该有机物的结构简式为________,写出其发生加聚反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则物质的量浓度是( )
A.11.9 B.11.9 mol·L-1 C.0.012 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 自然环境提供的能够为人类利用的淡水资源并不丰富,而且淡水资源缺乏的形势日益严峻。地球的海水总量约为1.3×109亿吨,是人类最大的水资源库。电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示:
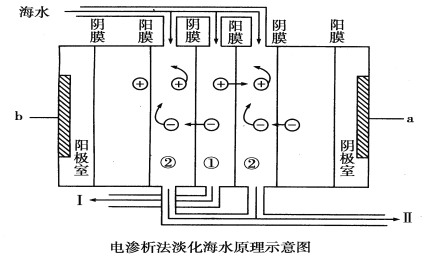
回答下列问题:
(1)大海中的海水________(填“能”或“不能”)直接通入到装置中,理由是_______________________。
(2)a是电源的________极,b是电源的________极。
(3)①是________室(填“淡水”或“浓水”),Ⅱ口排出的是________(填“淡水”或“浓水”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
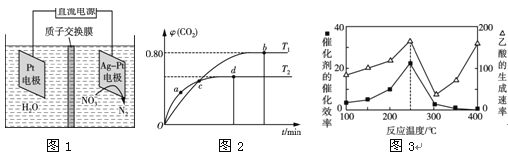
(1)若用4.48 L CH4还原NO生成N2,则放出的热量为 kJ(保留两位小数)。(气体体积已折算为标准状况下)
(2)用电化学处理含NO3—的废水,电解的原理如图1所示,则电解时阴极的电极反应式为 ;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(3)T1时,该反应的化学平衡常数的数值为 。
(4)下列说法不正确的是 (填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]() CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(5)250~300 ℃时,乙酸的生成速率减小的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法中错误的是( )
A.32 g O2所含的分子数目为NA
B.1 mol H2O含有的H2O分子数目为NA
C.1 mol H2O含有的氢原子数目为NA
D.0.5NA个O2分子的物质的量是0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 NA为阿伏加德罗常数的值。有关草酸(HOOC-COOH)的下列说法错误的是( )
A.9.0g草酸中共用电子对数目为0.9NA
B.9.0 g草酸被NaClO氧化生成CO2,转移的电子数为0.2 NA
C.9.0 g草酸溶于水,其中C2O42-和HC2O4-的微粒数之和为0.1NA
D.9.0g草酸受热完全分解为CO2、CO、H2O,标况下测得生成的气体体积为4.48 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com