
【题目】下列离子方程式中正确的是
A.向 CH2BrCOOH中加入足量的氢氧化钠溶液并加热:![]()
B.用氢氧化钠溶液除去铝片表面的氧化膜:Al3++4OH-→AlO2-+2H2O
C.次氯酸钠溶液中通入少量的CO2气体:ClO-+CO2+H2O→HClO+HCO3-
D.等体积、等浓度的Ca(HCO)2溶液和NaOH溶液混合:![]()
【答案】C
【解析】
A.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,羧基和氢氧化钠发生中和反应,溴原子在碱中发生水解反应,反应的化学方程式为:CH2BrCOOH+2OH-![]() CH2(OH)COO-+H2O,A选项错误;
CH2(OH)COO-+H2O,A选项错误;
B.用氢氧化钠溶液除去铝片表面的氧化膜,氧化膜的成分为氧化铝,反应的离子方程式为:Al2O3+2OH-===2AlO2-+H2O,B选项错误;
C.次氯酸钠溶液中通入少量的CO2气体,次氯酸的酸性大于碳酸氢根,则次氯酸钠与二氧化碳反应生成碳酸氢根,反应的方程式为:ClO-+CO2+H2O→HClO+HCO3-,C选项正确;
D.等体积、等浓度的Ca(HCO)2溶液和NaOH溶液反应,Ca2+和OH-为1:1,正确的离子反应方程式为Ca2++HCO3-+OH-===CaCO3↓+H2O,D选项错误;
答案选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】煤的综合利用是一个减少污染、提高燃料利用率的重要课题,其常用的方法包括煤的气化、液化以及转化为有机产品等。请回答下列问题:
(1)已知:I.C(s)、CO(g)、H2(g)的燃烧热依次为△H1=-393.5kJ·mol-1、△H2=-283.0kJ·mol-1、△H3=-285.8kJ·mol-1
II.H2O(l)=H2O(g)△H4=+44.0kJ·mol-1
则煤气化主要反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___。
CO(g)+H2(g)的△H=___。
(2)现在一恒温的刚性容器中加入足量煤,并通入1mol水蒸气,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
CO(g)+H2(g),则下列指标能够说明已到达平衡状态的有___ (填标号)。
①气体的密度保持不变;②断裂2molH-O键的同时生成1molH-H键;③CO的体积分数保持不变;④气体的平均摩尔质量不变;⑤CO与H2的比例保持不变;⑥容器的压强保持不变。
(3)气化后,将水煤气CO与H2化合CO(g)+2H2(g)![]() CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
CH3OH(g)可得到甲醇,最终实现煤的间接液化。已知在T℃时,其正反应速率为v正=k正·(CO)·c2(H2),逆反应速率为v逆=k逆·c(CH3OH),其中k为速率常数,其数值k正=97.5,k逆=39.0,则该温度下的平衡常数K=___;若在T℃下,向一体积为2L的刚性密闭体系中通入3molCO、2molH2和5molCH3OH,则此时证v正___v逆(填“大于”“小于”或“等于”)。
(4)关于CO(g)+2H2(g)![]() CH3OH(g),下列说法正确的是___(填字母)。
CH3OH(g),下列说法正确的是___(填字母)。
A.加压有利于速率加快和平衡向正反应方向移动
B.甲醇的平衡体积分数随着CO与H2投料比的增大而增大
C.使用催化性能好的催化剂,可提高H2的平衡转化率
D.在恒温恒容条件下达到平衡后,通入Ar,平衡向逆反应方向移动
E.已知E[CO(g)+2H2(g)]>E[CH3OH(g)](E表示物质的能量),则降温有利于提高正反应进行的程度
(5)在一特殊的恒容容器中,充入一定量的CO(g)与H2(g)来模拟CO(g)+2H2(g)![]() CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。
CH3OH(g),测得v正随时间的变化曲线如图所示,则t之前v正逐渐增大的原因为___;t之后v正又逐渐减小的原因为___。

(6)煤经过一系列转化还可得到草酸。常温下,向某浓度的草酸溶液中加入一定量某浓度的NaOH溶液,所得溶液中c(HC2O4-)=c(C2O42-),则此时溶液的pH=___(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭恒温容器中进行下列反应:aA(g)![]() bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
A.化学计量数a>b
B.容器容积增大,平衡向逆反应方向移动
C.容器容积增大,生成物B的质量分数增大
D.该反应的正反应放出热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤ 与
与 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.常温下,22.4L偏二甲肼气体的含C质量为24g
D.6 g偏二甲肼含有NA个N2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将43.2g FeC2O4隔绝空气加热,分解得到21.6g铁的氧化物,所得气体产物成分及物质的量是
A.0.3mol COB.0.3mol CO和0.3mol CO2
C.0.6mol CO2D.0.5mol CO和0.5mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是( )
)是最简单的一种。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体
B.二氯代物超过两种
C.所有碳原子均处同一平面
D.1mol螺[2,2]戊烷充分燃烧需要7molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A.把钠加入水中,有气体生成:2Na + H2O = Na2O+H2↑
B.用稀硫酸做导电实验,灯泡发光: H2O![]() H++OH-
H++OH-
C.向Al2(SO4)3溶液中滴加氨水,生成白色沉淀:Al3+ + 3OH- =Al(OH)3↓
D.用电子式表示NaCl的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:
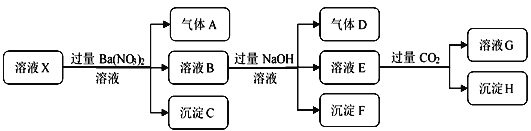
下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com