
分析 S2-水解呈碱性,以第一步水解为主,在Na2HPO4溶液中,存在着下列平衡:HPO42-?H++PO43-,HPO42-+H2O?H2PO4-+OH-,水解程度大于电离程度,而NaH2PO2溶液中存在着下列平衡:H2PO42-?H++HPO42-,H2PO42-+H2O?H3PO4-+OH-,电离程度大于水解程度,溶液呈酸性,以此解答该题.
解答 解:S2-水解呈碱性,发生S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,以第一步水解为主,Na2S水解程度较大,溶液具有较强碱性,在Na2HPO4溶液中,存在着下列平衡:HPO42-?H++PO43-,HPO42-+H2O?H2PO4-+OH-,水解程度大于电离程度,而NaH2PO2溶液中存在着下列平衡:H2PO42-?H++HPO42-,H2PO42-+H2O?H3PO4-+OH-,电离程度大于水解程度,溶液呈酸性,
答:S2-水解呈碱性,以第一步水解为主,Na2S水解程度较大,溶液具有较强碱性,NaH2PO2溶液为酸性,H2PO42-电离程度大于水解程度,Na2HPO4溶液为碱性,HPO42-水解程度大于电离程度.
点评 本题考查盐类的水解,为高频考点,侧重于双基的考查,注意把握盐类水解的规律和影响因素,注意相关基础知识的积累,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
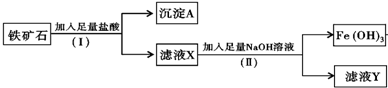
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
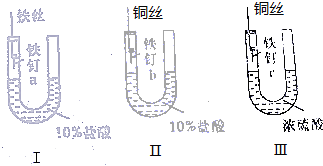 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说| A. | T℃下,只有在纯水中才有c(H+)•c(OH-)=10-13 | |
| B. | 图中直线上的任意点都显中性 | |
| C. | T℃时,pH=7的溶液显碱性 | |
| D. | T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com