
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
分析 A、实验①与实验②互为等效平衡,根据极限转化得a为0.9,平衡时为0.8,说Y在消耗,反应从逆方向开始;
B、根据化学平衡常数的概念计算;
C、实验③相当于在②的平衡加压;
D、实验③和④温度不同,极限转化为同种物质表示时,物质的起始量也不同,不能比较出温度发影响.
解答 解:A、实验①与实验②平衡状态相同,则互为等效平衡,通过极限转化为同种物质表示时,同种物质的投入应该相同,故a=0.9,即起始时Y为0.9,平衡时为0.8,说明反应从逆方向开始,即V(逆)>V(正),故A错误;
B、根据实验①X(g)═Y(g)+Z(g)
起始量:1 0 0
转化量:0.8 0.8 0.8
平衡量:0.2 0.8 0.8
则K=$\frac{(0.8÷5)•(0.8÷5)}{(0.2÷5)}$=0.64,故B错误;
C、将实验③的物质通过极限转移为X,为1.5mol,为实验①的1.5倍,可以看做是在实验①容器容积的1.5倍的容器中达到平衡后,再压缩至5L容器达到的平衡,若平衡不移动,b=1.2,压缩体积,该反应逆向移动,b<1.2,故C正确;
D、实验③和④温度不同,极限转化为同种物质表示时,Y为1.7,Z为1.5,物质的起始量也不同,不能得到温度对该平衡的影响,故D错误;
故选C.
点评 本题考查了对等效平衡的计算,化学平衡常数的计算,知识较为综合,难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 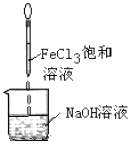 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑤⑦⑥ | B. | ④⑥③⑦⑤⑥ | C. | ②⑥③⑦⑤⑥ | D. | ①⑥③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.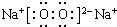 ,该产物所含有的化学键类型有离子键、非极性键.
,该产物所含有的化学键类型有离子键、非极性键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 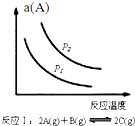 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
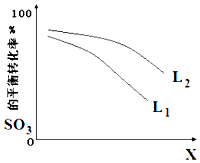 高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com