
| A、Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑ |
| B、Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑ |
| C、Na2S(少量)+CH3COOH=CH3COONa+NaHS |
| D、CH3COOH+NaHS=CH3COONa+H2S↑ |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18 g?mol-1 |
| B、3.01×1023个SO2分子的质量为32 g |
| C、CH4的摩尔质量为16 g |
| D、1 mol任何物质均含有6.02×1023个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| D、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
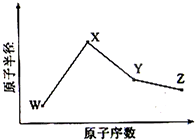 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )| A、X位于元素周期表中第三周期第IA 族 |
| B、W的基态原子核外有2个未成对电子 |
| C、X的单质和Y的单质相比,熔点较高的是X |
| D、Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com