
【题目】淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2 溶液没有白色沉淀产生 D.加入碘水变蓝
科目:高中化学 来源: 题型:
【题目】现有以等物质的量混合的NaHCO3和KHCO3的混合物a g与100 mL盐酸反应.(题中涉及的气体体积以标准状况计,填空时可以用带字母的数学式表示,不必化简)
(1)该混合物中NaHCO3和KHCO3的质量比为 .
(2)如果反应后盐酸不足量,要计算生成CO2的体积,还需知道 , 理由是 .
(3)若该混合物与盐酸恰好完全反应,则盐酸的物质的量浓度为
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
(1)写出基态E原子的电子排布式 .
(2)1mol A的单质分子中π键的个数为 .
(3)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(4)A的简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(5)C和D形成的化合物的晶胞结构如图,已知晶胞边长a cm,阿伏加德罗常数为NA , 求晶体的密度为ρ=g/cm3 . (用含a、NA的计算式表示) 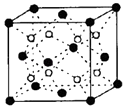
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+ ![]() Fe3+
Fe3+ ![]() FeO
FeO ![]() (高铁酸根离子)回答下列有关问题:
(高铁酸根离子)回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是 .
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是 , 每生成l mol Na2FeO4转移mol电子.
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式: .
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( ) 
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧洲核子研究中心于1995年9月~10月间研制成世界上第一批反原子——共9个反氢原子,揭开了人类制取、利用反物质的新篇章。则下列关于反氧原子说法正确的是( )
A.核内有8个带正电的质子,核外有8个带负电的电子
B.核内有8个带负电的电子,核外有8个带正电的质子
C.核内有8个带负电的中子,核外有8个带正电的质子
D.核内有8个带负电的质子,核外有8个带正电的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①甲醇、②乙醛、③苯、④聚乙烯、⑤苯酚、⑥环己烷、⑦邻二甲苯、⑧环己烯( ![]() ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
A.②④⑤⑧
B.②⑤⑧
C.②④⑤⑦
D.②④⑤⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com