
| A、电解精炼铜时,当阳极上质量减少6.4g时,电路上转移的电子数目为0.2 NA |
| B、1L 1.0mol?L-1NH4Cl与2L 0.5mol?L-1NH4HSO4溶液含NH4+数目相同 |
| C、0.2mol Zn与一定量浓H2SO4恰好完全反应,生成的气体分子数必为0.2NA |
| D、将2mL0.5 mol?Lˉ1Na2SiO3溶液滴入稀盐酸中制得H4 SiO4胶体,所含胶粒数为0.001NA |


科目:高中化学 来源: 题型:
| A、m>n | B、m<n |
| C、m=n | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>② | B、①<② |
| C、①=② | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
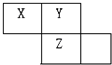 X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A、Z的氧化物对应的水化物一定是一种强酸 |
| B、原子半径大小顺序是X>Y>Z |
| C、Z单质与Fe反应形成的化合物中,铁元素显+3价 |
| D、Y的单质比Z的单质更易与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L 乙烯所含碳原子数为NA |
| B、1L 0.1 mol?L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA |
| C、32g O2和 O3的混合气体中含有的氧原子数为2NA |
| D、5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- |
| B、H3PO4溶于水:H3PO4═3H++PO43- |
| C、HF溶于水:HF?H++F- |
| D、NaHS溶于水:NaHS═Na++HS-,HS-?H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑ |
| B、氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
| C、碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br- |
| D、碳酸氢镁溶液中加过量澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com