
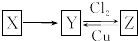
 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):分析 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,
(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y未亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4.
解答 解:(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y未亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4.Z和Cu反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查无机物的推断,题目难度不大,本题注意根据反应的转化关系结合物质的相关性质为解答的突破口进行推断,牢固把握元素化合物知识是解答该类题目的前提,试题培养了学生的分析、理解能力及逻辑推理能力.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中一定不存在化学键 | B. | 离子晶体中只存在离子键 | ||
| C. | 在共价化合物中一定有共价键 | D. | 非金属原子间只能形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗的A与生成的B物质的量之比为1:3 | |
| B. | 混合物各物质浓度的浓度相等 | |
| C. | 容器内A、B、C三种物质共存 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈橙色不分层 | B. | 溶液分两层,上层呈橙色 | ||
| C. | 溶液分两层,下层呈橙色 | D. | 溶液呈紫色不分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C<N<O<F | B. | 最高正化合价:Si<P<S<Cl | ||
| C. | 热稳定性:GeH4<SiH4<CH4 | D. | 酸性:H3CO3<H2SiO3<Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O | |
| C. | 5H218O2+2KMnO4+3H2SO4═518O2↑+K2SO4+2MnSO4+8H2O | |
| D. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价:P<S<Cl | B. | 原子半径:O<S<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 失电子能力:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甲 组 | 乙 组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:剧烈反应,很快产生大量气体. 铝:也产生大量气体,但反应比镁慢. | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:开始时没有现象,过一会儿产生大量气体. 铝:基本没有变化. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com