

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
分析 装置A中是利用试剂X为浓盐酸滴入二氧化锰固体中加热反应生成氯气、氯化锰、水,生成的氯气中含水蒸气和氯化氢,通过装置B中的饱和食盐水除去氯化氢,通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价:可推知C中反应生成的含氯氧化物为Cl2O;反应的化学方程式为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.剩余气体不能排放需要用装置E中氢氧化钠溶液吸收,
(1)实验室制备氯气是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)依据装置分析,进入C之前需要吸收氯化氢气体,需要用饱和食盐水吸收;
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3.
②步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
(4)①依据氧化还原反应电子守恒计算判断氯元素化合价写出化合物化学式,依据反应物和生成物配平书写化学方程式;
②假设二:存在三种成分:NaHCO3和NaCl和Na2CO3,测定碳酸氢钠的含量,可以利用固体中碳酸氢钠加热分解,测定反应前后质量变化计算碳酸氢钠的质量得到质量分数.
解答 解:(1)实验室制备氯气,结合装置分析可知是利用二氧化锰和浓盐酸加热反应生成氯气,反应的离子方程式为:4H++2Cl-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:4H++2Cl-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)实验制备氯气中含有氯化氢气体,需要用饱和食盐水除去;
故答案为:饱和食盐水;
(3)①在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.
假设存在两种成分,为NaHCO3和NaCl;
假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3,
故答案为:NaCl;NaCl、Na2CO3;
②步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中,无明显现象,步骤2中向A试管中滴加适量BaCl2溶液,是检验产物中是否有Na2CO3,回答该小题时要结合最后的结论,a应为证明固体中不含Na2CO3,b应为证明固体中含Na2CO3,不能颠倒.
步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;
故答案为:
| 实验步骤 | 预期现象和结论 |
| BaCl2溶液 | |
| AgNO3溶液和稀硝酸 |
点评 本题考查了物质性质验证的实验设计,步骤分析判断,现象分析理解,掌握物质性质和实验设计方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.5 | B. | 17 | C. | 22 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
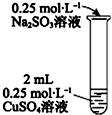 | i有黄色沉淀出现,随着Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
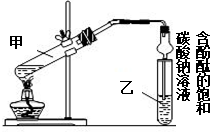 某学习小组在实验室制取乙酸乙酯的主要步骤如下:
某学习小组在实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com