
| 编号 | ① | ② | ③ | ④ |
| 操作示 意图 | 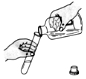 |  | 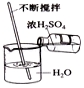 |  |
| 操作名称 | 倾倒液体 | 取用块状固体 | 稀释浓硫酸 | 检查气密性 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
分析 A.倾倒液体试管倾斜45°,口对口,瓶塞倒放,标签正对手心;
B.取用块状固体,试管要横放,固体放在管口,然后缓缓直立;
C.将浓硫酸注入水中,不断搅拌,使产生的热量及时散失;
D.双手紧握试管,试管中气体膨胀,烧杯中观察有气泡可检验气密性.
解答 解:A.倾倒液体试管倾斜45°,口对口,瓶塞倒放,标签正对手心,操作合理,故A正确;
B.取用块状固体,试管要横放,固体放在管口,然后缓缓直立,图中操作易使试管底破裂,故B错误;
C.将浓硫酸注入水中,不断搅拌,使产生的热量及时散失,图中操作合理,故C正确;
D.双手紧握试管,试管中气体膨胀,烧杯中观察有气泡可检验气密性,图中方法和操作合理,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
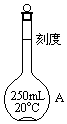 欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;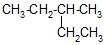 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;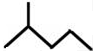 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
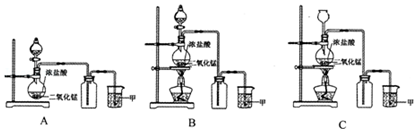
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
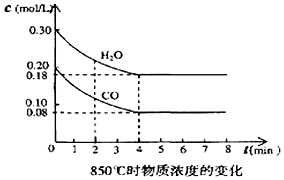 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑥ | B. | ①②③ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
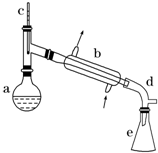 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: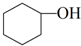 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com