
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
①CH3OCH3②HCOOCH2CH3③CH3COCH3④![]() ⑤CH3CHO⑥
⑤CH3CHO⑥![]() ⑦
⑦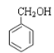
A.属于酯的是__;(填序号,下同)
B.属于酮的是__;
(2)下列各组物质:
①O2和O3;②乙醇和甲醚;③淀粉和纤维素;④苯和甲苯;⑤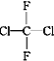 和
和![]()
![]() ;⑥
;⑥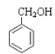 和
和![]() ;⑦CH3CH2NO2和
;⑦CH3CH2NO2和![]()
A.互为同系物的是__;(填序号,下同)
B.属于同一种物质的是__。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68LCO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是__,有机物A的分子式为__。
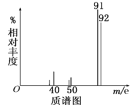
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为__。
【答案】② ③ ④ ⑤ 92 C7H8 ![]()
【解析】
(1)①CH3OCH3属于醚类;②HCOOCH2CH3属于酯类;③CH3COCH3属于酮类;④![]() 属于酸类;⑤CH3CHO属于醛类;⑥
属于酸类;⑤CH3CHO属于醛类;⑥![]() 属于酚类;⑦
属于酚类;⑦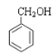 属于醇类;
属于醇类;
(2)①O2和O3互为同素异形体;②乙醇和甲醚互为同分异构体;③淀粉和纤维素为不同物种;④苯和甲苯互为同系物;⑤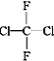 和
和![]()
![]() 为同一物种;⑥
为同一物种;⑥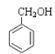 和
和![]() 不属于同系物;⑦CH3CH2NO2和
不属于同系物;⑦CH3CH2NO2和![]() 互为同分异构体;
互为同分异构体;
(1)①CH3OCH3属于醚类;②HCOOCH2CH3属于酯类;③CH3COCH3属于酮类;④![]() 属于酸类;⑤CH3CHO属于醛类;⑥
属于酸类;⑤CH3CHO属于醛类;⑥![]() 属于酚类;⑦
属于酚类;⑦ 属于醇类;
属于醇类;
A.属于酯的是②;B.属于酮的是③。
(2)①O2和O3互为同素异形体;②乙醇和甲醚互为同分异构体;③淀粉和纤维素为不同物种;④苯和甲苯互为同系物;⑤ 和
和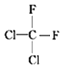 为同一物种;⑥
为同一物种;⑥ 和
和![]() 不属于同系物;⑦CH3CH2NO2和
不属于同系物;⑦CH3CH2NO2和![]() 互为同分异构体;
互为同分异构体;
A.互为同系物的是④;B.属于同一种物质的是⑤。
(3)A为芳香烃,则只含有C、H;标况下15.68LCO2的物质的量为0.7mol,7.2gH2O的物质的量为0.4mol,则n(C):n(H)=7:8,根据质谱图,可判断其分子量为92,9.2g为0.1mol,分子的物质的量与含碳、含氢的物质的量之比为0.1:0.7:0.8,则分子式为C7H8;其核磁共振氢谱中含有四个峰的面积之比是1∶2∶2∶3,则含有1个甲基,且结构为对称结构,可判断其为甲苯,结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子原理,O3分子的空间构型为________。
(3)氯与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为____________________。
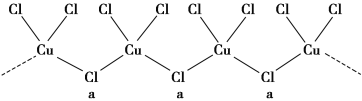
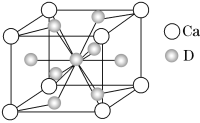
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=______________________(填数值);氢在合金中的密度为________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体亚硫酸氢钠,c(H+)增大,水的电离程度增大
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在适宜的条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca(OH)2+2H2↑
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。
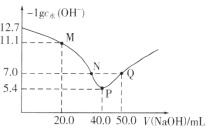
下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
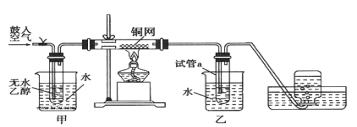
(1)请写出装有铜网的试管中反应的化学方程式:___。
(2)不断鼓入空气,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是____反应(填“吸热”或“放热”)。
(3)甲和乙两个水浴作用不相同。甲的作用是___;乙的作用是___。
(4)反应进行一段时间后,集气瓶收集到的气体主要是___。
(5)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,选择的试剂是__(填写字母):
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.金属钠
再通过___(填实验操作名称)即可得到乙醛。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是![]()
A.使PH试纸变成红色的溶液,可能存在大量的:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 溶液中,可能存在大量的:
溶液中,可能存在大量的:![]() 、
、![]() 、
、![]() 、
、![]()
C.硫酸酸化的淀粉KI溶液在空气中变成蓝色:![]()
D.![]() 溶液中滴加少量澄清石灰水:
溶液中滴加少量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置在实验室制备乙酸乙酯
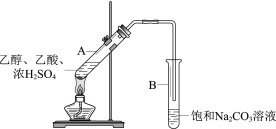
(1)实验中饱和Na2CO3溶液的作用是__________。
(2)分离出试管B中油状液体用到的主要仪器是_________________。
(3)乙醇和乙酸反应制乙酸乙酯是可逆反应。请根据化学平衡移动的相关知识写出一种增大乙酸乙酯产率的方法_________________。
(4)工业上用CH2=CH2和乙酸直接反应获得乙酸乙酯
①其反应类型是____。
②与实验室制法相比,工业制法的优点是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com