
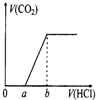
 在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )
在100mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如图所示,有关说法错误的是( )| A、若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+=HCO3- |
| B、若a:b>l:2,且b=20 mL,则原NaOH溶液的浓度为0.02 mol/L |
| C、若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D、a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| 0.002mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、v(Fe)=0.5 mol?L-1?min-1 |
| B、v(H2SO4)=1 mol?L-1?min-1 |
| C、v(H2)=1 mol?L-1?min-1 |
| D、v(FeSO4)=0.5 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
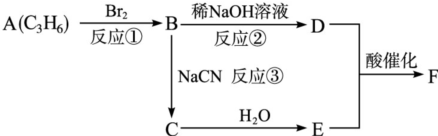
| NaCN |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
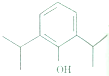 2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )
2009年8月25日洛杉矶首席验尸官在休斯顿法庭上公布流行音乐天王杰克逊被注射异丙酚,“天王星”就此陨落.异丙酚是一种强力的镇静剂,常被麻痹医生称为“牛奶”.其结构如图所示,下列有关异丙酚的说法不正确的是( )| A、能发生加成反应 |
| B、能和FeCl3溶液发生显色反应 |
| C、能与Na2CO3溶液发生反应 |
| D、分子中所有碳原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-114.6kJ?mol-1 | ||
B、燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
| ||
| C、若常温时H2(g)的燃烧热是285.8 kJ?mol-1,则2H2O(g)=2H2(g)+O2(g)△H=+571.6kJ?mol-1 | ||
| D、常温时葡萄糖的燃烧热是2800 kJ?mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O( l )△H=-1400 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al和 NaOH溶液 |
| B、NaOH溶液和AlCl3溶液 |
| C、Na和O2 |
| D、NaOH溶液和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com