
| A. | 碳酸氢盐 | B. | 电解质 | C. | 钠盐 | D. | 碱性氧化物 |
分析 A.盐是电离出金属阳离子(铵根离子)和酸根阴离子的化合物,碳酸氢盐是电离生成的阴离子是碳酸氢根离子的盐;
B.电解质是溶于水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物;
C.钠盐是含有金属阳离子钠离子的盐;
D.氧化物是由两种元素组成的化合物,其中一种元素为O,碱性氧化物指能和酸反应生成盐和水的氧化物.
解答 解:A.碳酸氢钠属于盐,电离方程式为:NaHCO3═Na++HCO3-,阴离子是碳酸氢根离子,故A不选;
B.碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3═Na++HCO3-,故B不选;
C.碳酸氢钠电离出阳离子为钠离子,属于钠盐,故C不选;
D.“NaHCO3”含有钠、氢、碳、氧四种元素,不属于氧化物,故D选;
故选D.
点评 本题考查物质的分类,关键是要知道电解质、氧化物的特点和盐的命名方法,题目较简单.


科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “探险队员”--盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过.
“探险队员”--盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3- | B. | Al3+、OH-、SO42- | C. | H+、Na+、HCO3- | D. | NH4+、Ca2+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
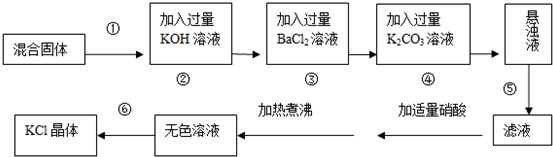
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液 | B. | HI溶液 | C. | NaOH溶液 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3 | B. | BaCl2 | C. | NaOH | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com