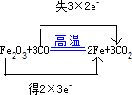
在Fe2O3+3CO═2Fe+3CO2的反应中
(1) 是氧化剂; 是还原剂;该反应中 表现氧化性; 表现还原性.
(2)当电子转移的数目为6.02×1023个时生成的CO2的物质的量为 mol.
【答案】
分析:(1)所含元素化合价降低的反应物是氧化剂,所含元素化合价升高的反应物是还原剂,反应中氧化剂表现氧化性,还原剂表现还原性.
(2)反应中CO→CO
2,碳元素的化合价由+2价升高为+4价,每生成1molCO
2转移电子2mol,据此计算.
解答:解:(1)反应中Fe
2O
3→Fe,铁元素化合价由+3价降低为0价,Fe
2O
3是氧化剂,表现氧化性;反应中CO→CO
2,碳元素的化合价由+2价升高为+4价,CO是还原剂,表现还原性.
故答案为:Fe
2O
3,CO,Fe
2O
3,CO.
(2)6.02×10
23个电子的物质的量为1mol,反应中CO→CO
2,碳元素的化合价由+2价升高为+4价,每生成1molCO
2转移电子2mol,所以转移1mol电子生成CO
2的物质的量为

=0.5mol.
故答案为:0.5mol.
点评:考查氧化还原反应基本概念、计算等,难度不大,掌握常见元素、原子团的化合价是判断氧化剂、还原剂的关键.

 =0.5mol.
=0.5mol.