
| A. | 1:3 | B. | 2:3 | C. | 1:4 | D. | 2:1 |
分析 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答 解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半($\frac{1}{2}$c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7;
当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3.
故选B.
点评 本题考查化学方程式的计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意根据题给信息以及反应的相关方程式解答该题,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{112}$Cd原子的中子数为64 | |
| B. | 聚氯化铝能降污是因为它有强氧化性 | |
| C. | 聚氯化铝是混合物 | |
| D. | 镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
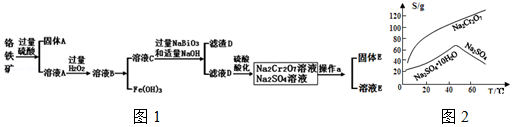
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
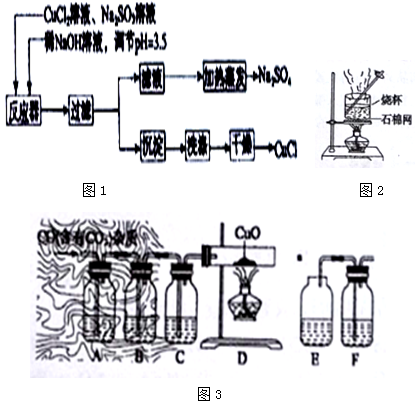
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
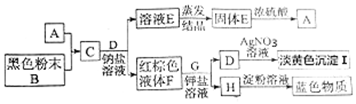
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
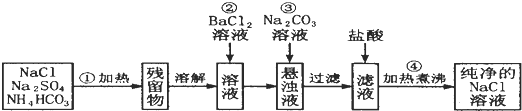
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
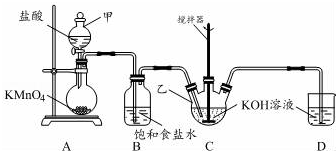 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com