
分析 (1)铜是29号元素,根据核外电子排布规律书写;
(2)根据晶胞的边长为361pm,其体积为(361pm)3;晶胞的质量=体积×密度;铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,据此计算NA.
解答 解:(1)铜是29号元素,满足半满和全满的稳定结构,其基态原子的电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)1pm=10-10cm,故一个晶胞的体积为(361×10-10cm)3=4.7×10-23cm3;晶胞的质量=体积×密度,故一个晶胞的质量为4.7×10-23cm3×9.00g•cm-3=4.23×10-22g;铜的晶胞为面心立方最密堆积,一个晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,所以63.6g•mol-1=$\frac{1}{4}$×4.23×10-22g×NA,得NA=6.01×1023mol-1,
故答案为:4.7×10-23;4.23×10-22;6.01×1023mol-1.
点评 本题以铜元素及其化合物为载体,综合考查物质结构与性质的主干知识,注意晶胞的结构,题目难度较大.


科目:高中化学 来源: 题型:实验题
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | CH4、HCl、NH3 | D. | NO、SO3、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
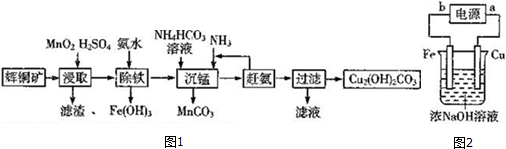
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | [ZnCl4]2-空间构型呈平面四边形 | |
| B. | [ZnCl4]2-空间构型呈正四面体形 | |
| C. | [ZnCl4]2-离子中存在2个σ键和2个π键 | |
| D. | [ZnCl3F]2-不存在着同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 美国一些科学家开发利用人体能,一些超级市场将顾客拉门消耗的能量贮存起来转化为电能,用于超级市场的电能消耗 | |
| B. | 英国农村大面积种植油菜,用植物油代替石油 | |
| C. | 英国科学家对一种嗜热链球菌进行基因移植后,新繁殖后的大量细菌在较高温度下,把稻草中的植物纤维转变为乙醇 | |
| D. | 英美科学家在酶的作用下将水分解成氢气和氧气,利用其释放的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯与溴单质加成的产物只有2种 | |
| B. | 酚酞( )属于醇 )属于醇 | |
| C. | 可以用溴水将四氯化碳和乙醇鉴别开来 | |
| D. | 分子组成相差一个或若干个CH2原子团的化合物肯定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的盐酸和0.1mol/L的氨水溶液 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 | |
| C. | pH=4的醋酸溶液和pH=10的氢氧化钠溶液 | |
| D. | pH=4的盐酸和pH=l0的氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com