
实验室需要0.1 mol·L-1NaOH溶液450 mL和
0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
_______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
【解析】(1)溶液配制时不用圆底烧瓶和分液漏斗,还必须有溶解用的烧杯和搅拌、引流用的玻璃棒。
(2)容量瓶不能用来直接溶解、稀释、贮存溶液,容量瓶只有一个刻度线,只能用来测量容积所标明的溶液的体积。
(3)应配制500 mL NaOH溶液,则m(NaOH)=0.5 L×0.1 mol·L-1×40 g·mol-1=
2.0 g。定容时若仰视刻度线,则实际溶液体积偏大,则配制溶液浓度偏低,即小于0.1 mol·L-1。若NaOH溶液未经冷却就转入容量瓶定容,温度冷却到标定温度时,溶液体积偏小,导致所配NaOH溶液浓度偏大,即大于0.1 mol·L-1。
(4)浓硫酸的浓度为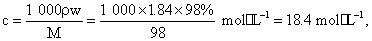 则0.5 mol·L-1×500 mL=18.4 mol·L-1×V,V=13.6 mL,要注意浓硫酸稀释的操作要点。
则0.5 mol·L-1×500 mL=18.4 mol·L-1×V,V=13.6 mL,要注意浓硫酸稀释的操作要点。
答案:(1)A、C 烧杯、玻璃棒
(2)B、C、E
(3)2.0 小于 大于
(4)13.6 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1。则平衡时H2的浓度(mol·L-1)是( )
A.0.16 B.0.08
C.0.04 D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
下列数据是对应物质的熔点
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
据此做出的下列判断中错误的是
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为 。
(2)元素B、C、D的第一电离能的由小到大排列顺序为 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________ 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____ 。
 碳铂中含有的作用力有 (填字母)。
碳铂中含有的作用力有 (填字母)。
A.共价键 B.配位键
C.金属键 D. 键 E.
键 E. 键
键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p= g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中存在五种离子: 、
、 、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2∶3∶1∶3∶1,则未知离子可能为 ( )
A.Fe2+ B.Ba2+ C.Cl- D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1 分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.0025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程与焓变有关
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
A.氢氧化钠溶液中通入少量二氧化硫:SO2+OH-===HSO
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH-===H2O
D.碳酸钙溶解于稀硝酸中:CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com