
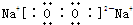 ;
;分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,则C为N元素;D和F同主族,则F为S元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子,则A为H元素;A和E同主族,结合原子序数可知E为Na;B与D最外层电子数之比为2:3,由原子序数可知,二者都处于第二周期且不相邻,故B、D原子最外层电子数分别为4、6,可推知B为C元素、D为O元素,则C为N元素;D和F同主族,则F为S元素.
(1)由上述分析可知,A为氢元素;E为Na元素,处于周期表中第三周期ⅠA族,
故答案为:氢;第三周期ⅠA族;
(2)非金属性O>N>S,故N、O、S元素氢化物的稳定性H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(3)Na单质在足量氧气中燃烧生成的化合物为Na2O2,其电子式为: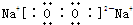 ,
,
故答案为: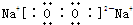 ;
;
(4)化合物X、Y均由H、O、Na、S四种元素组成,分别为NaHSO3、NaHSO4中的一种,
①NaHSO3、NaHSO4均属于离子化合物;
②X与Y的水溶液相混合发生反应的离子方程式为:H++HSO3-=H2O+SO2↑;
故答案为:离子;H++HSO3-=H2O+SO2↑;
(5)化合物Na2S的水溶液中滴入双氧水和稀硫酸,加热,生成单质为S,同时生成水,其反应离子方程式为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O,
故答案为:S2-+H2O2+2H+$\frac{\underline{\;\;△\;\;}}{\;}$S↓+2H2O;
(6)若由A、C组成的简单氢化物为氨气,氨气燃烧生成无污染物,该产物应该为氮气,氨气的燃烧热为aKJ/mol,则氨气燃烧热的热化学方程式为:NH3(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l);△H=-aKJ/mol,
故答案为:NH3(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2O(l);△H=-aKJ/mol.
点评 本题考查结构性质位置关系综合应用,难度不大,推断元素是解题关键,注意充分利用原子序数关系确定元素,(6)为易错点,学生容易忽略书写燃烧热的热化学方程式.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
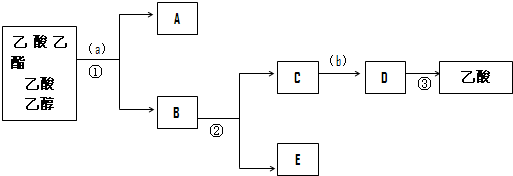
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的原电池装置,则:
如图所示的原电池装置,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C2H6O | D. | C2H6O C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 放热反应一定比吸热反应的反应速率快 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程 | |
| D. | 反应速率快的反应,其反应物的转化率一定高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com