
 是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
 ,根据D的分子式C7H6O3以及E的结构简式可以推断D为
,根据D的分子式C7H6O3以及E的结构简式可以推断D为 ,可与甲醇反应生成E,则X为CH3OH,据此答题;
,可与甲醇反应生成E,则X为CH3OH,据此答题; ,根据D的分子式C7H6O3以及E的结构简式可以推断D为
,根据D的分子式C7H6O3以及E的结构简式可以推断D为 ,可与甲醇反应生成E,则X为CH3OH,
,可与甲醇反应生成E,则X为CH3OH, CH3COOH+Cu2O↓+2H2O或CH3CHO+2Cu(OH)2+NaOH
CH3COOH+Cu2O↓+2H2O或CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O,
CH3COONa+Cu2O↓+3H2O, CH3COOH+Cu2O↓+2H2O或CH3CHO+2Cu(OH)2+NaOH
CH3COOH+Cu2O↓+2H2O或CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O;
CH3COONa+Cu2O↓+3H2O; +CH3OH
+CH3OH
 +H2O,
+H2O, +CH3OH
+CH3OH
 +H2O;
+H2O; ,含有苯环和酯基的同分异构体应为加酸苯酚酯,且含有酚羟基,有邻、间、对3种,它们是
,含有苯环和酯基的同分异构体应为加酸苯酚酯,且含有酚羟基,有邻、间、对3种,它们是 、
、 、
、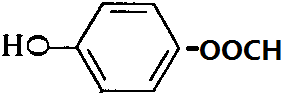
 、
、 、
、 (其中任一种);
(其中任一种);


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、O2>I2>S |
| B、O2>S>I2 |
| C、I2>O2>S |
| D、S>I2>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:

| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液
如图所示X、Y分别为直流电源的两极,Z溶液可能为:①稀硫酸 ②NaOH溶液 ③Na2SO4 溶液 ④CuCl2 溶液 ⑤NaCl溶液 ⑥稀盐酸 ⑦CuSO4 溶液查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1 Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
| B | 向乙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定乙醛中是否含有醛基 |
| C | 向苯和酒精的混合液中加入金属钠 | 确定苯中是否有酒精 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制标准溶液所用的氢氧化钠已经潮解 |
| B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C、未用标准液润洗碱式滴定管 |
| D、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com