
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)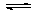 2NH3(g) △H<0相关数据如下表所示下列说法正确的是
2NH3(g) △H<0相关数据如下表所示下列说法正确的是
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3mol的H2 | 2mol的NH3 | 2mol的NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应平衡常数K=c2(NH3)/c(N2)?c3(H2) | K甲 | K乙 | K丙 |
平衡时NH3的浓度(mol/L) | C甲 | C乙 | C丙 |
平衡时NH3的反应速率(mol/L?min) | v甲 | v乙 | v丙 |
A.V甲>V乙 B.K乙>K丙 C.c乙>c甲 D.υ甲=υ丙
B、C
【解析】
试题分析:A.由于反应起始温度和起始体积相同,甲是在恒温恒容条件下进行的反应,乙是在绝热恒容条件下进行的反应,所以反应达到平衡时,V甲=V乙,错误;B.对于丙,可以认为2mol的氨气是1molN2、3mol的H2反应产生的,若与甲都是在恒温恒容条件下,则为等效平衡。由于该反应的正反应是气体体积减小的反应,则逆反应是气体体积增大的反应。随着反应的进行,气体的物质的量不断增大,当达到平衡时气体的压强达到最大值,为了维持压强与开始相同,则容器的容积就要增大,所以平衡浓度比甲小,由于反应物系数大,减小的多,所以化学平衡常数K乙比K甲大,即K乙>K丙,正确;C.该反应的正反应是放热反应,甲从反应的正反应方向开始,乙从反应的逆反应方向开始。在反应开始时两个容器的容积相等。但是甲保持恒容,乙保持恒温,则对于乙随着反应的进行,温度逐渐降低,降低温度,平衡向放热的方向移动,对该反应来说,平衡正向移动,所以达到平衡时NH3的浓度:c乙>c甲,正确;D.甲恒温恒容,由于随着反应的进行,气体的物质的量逐渐减小,容器的压强逐渐减小,而丙是恒温恒压,为了维持压强不变,则就应该容器的容积增大,物质的浓度降低,所以反应速率就比甲小,即υ甲>υ丙,错误。
考点:考查可逆反应化学平衡移动、物质的反应速率、平衡浓度等关系的知识。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:单选题
2009年3月22日 是第17届世界水日(world water day)。自来水生产中通常使用少量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,可用下列一种化学试剂来鉴别,该试剂是 ( )
| A.酚酞试液 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:①C(s)+1/2O2(g)=CO(g) △H1=-110.35kJ/mol;
②2H2O(l)=2H2(g)+ O2(g) △H2=+571.6kJ/mol
③H2O(l)=H2O(g) △H3=+44.0kJ/mol
则:C(s)+ H2O(g)=CO(g)+H2(g) △H4= 。
(2)燃料气(流速为1800mL?h-1;体积分数为:50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 。
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图所示。

加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好。催化剂为CuO/CeO2-HIO3,120℃时,反应1小时后CO的体积为 mL。
(3)下图为甲酸质子交换膜燃料电池的结构示意图。

该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
载人空间站的生态系统中,要求分离人呼出的二氧化碳,同时需要提供氧气。某电化学装置利用太阳能转化的电能可以实现上述要求,同时还有燃料一氧化碳生成,该电化学装置中得电子的电极发生的反应是2CO2+4e-+2H2O===2CO+4OH-。下列判断错误的是
A.上述电化学装置相当于电解池
B.上述装置进行的总反应为2CO2==2CO+O2
C.反应结束后该电化学装置中的电解质溶液pH增大
D.失电子的电极发生的反应是4OH--4e-==2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质的性质的应用不正确的是
A.甲醛能使蛋白质变性,常用高浓度甲醛溶液浸泡食用海产品以防腐
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.过氧化钠能与二氧化碳反应产生氧气,可用作潜水艇的供养剂
D.锌的金属活泼型比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高二上学期期末化学试卷(解析版) 题型:选择题
丁苯橡胶是最早工业化的合成橡胶,它大部分用于轮胎工业,其它产品有汽车零件、工业制品、电线和电缆包皮、胶管、胶带、鞋类、运动器件和玩具等。丁苯橡胶的结构简式如下:

合成这种橡胶的单体应是
①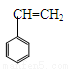 ②CH3—CH=CH—CH3 ③CH2=CH—CH=CH2
②CH3—CH=CH—CH3 ③CH2=CH—CH=CH2
④CH2==CHCH3 ⑤
A.①③ B.④⑤ C.③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省潍坊市高一上学期1月月考化学试卷(解析版) 题型:选择题
氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于置换反应 D.生成1molN2有12mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com