
)某班学生分成甲,乙两小组分别探究硫,氮及其化合物的性质:
(一)甲组同学用图1装置来探究浓硫酸与木炭粉加热反应并验证反应所产生的各种产物.
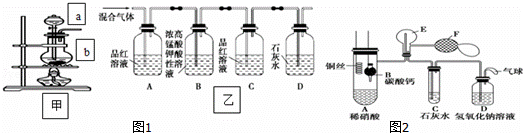
(1)装置甲中盛放浓硫酸的仪器a名称是 ,装置甲中仪器b中发生反应的化学方程式为
(2)实验中可观察到装置乙中,A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是 ,
D瓶溶液的现象是 .
(二)乙组同学用图2装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的是 .
(2)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 .
(3)一段时间后,C中白色沉淀溶解,其原因是
(4)装置D的作用是
考点: 浓硫酸的性质实验;硝酸的化学性质.
分析: (一) (1)仪器a的名称为分液漏斗;仪器b中碳与浓硫酸加热反应生成二氧化碳、二氧化硫和水;
(2)A中品红溶液用于检验混合气体中含有二氧化硫,B、C装置分别除去并检验二氧化硫已经除尽,D中盛放澄清石灰水,用于检验二氧化碳气体;
(二)要验证铜与稀硝酸反应生成一氧化氮,则应将装置中的O2排出.当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,但由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深;随着反应的不断进行,E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解.D装置用来吸收尾气,防止污染环境,据此进行解答.
解答: 解:(一) (1)根据图示可知,仪器a为分液漏斗;仪器b中碳与浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O,
2SO2↑+CO2↑+2H2O,
故答案为:分液漏斗;C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)根据图示装置及实验目的可知,要检验二氧化硫和二氧化碳气体,应该先用品红溶液检验二氧化硫,然后用酸性高锰酸钾溶液除去二氧化硫,再用品红溶液检验二氧化硫已经除尽,最后用澄清石灰水检验二氧化碳,所以装置A的作用是检验二氧化硫,装置D中澄清石灰水变浑浊证明产物中含有二氧化碳气体,
故答案为:检验SO2;澄清石灰水变混浊;
(二)(1)当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,以防止氧化生成的NO,
故答案为:产生二氧化碳,排出装置中的空气;
(2)由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深,
故答案为:二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮;
(3)E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解,
故答案为:二氧化氮与水反应生成硝酸,硝酸使白色沉淀碳酸钙溶解;
(4)D装置用来吸收尾气,防止污染环境,
故答案为:吸收尾气,防止污染大气.
点评: 本题综合考查物质的性质实验探究,题目难度中等,涉及碳与浓硝酸、铜与稀硝酸的反应以及常见气体的性质及检验方法,侧重于学生的分析能力和实验能力的考查,为高考常见题型.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
将2molI2(g)和1molH2置于某2L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)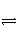
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
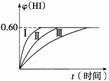 (1)达到平衡时,I2(g)的物质的量浓度为__________
(1)达到平衡时,I2(g)的物质的量浓度为__________
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L的密闭容器中加入amolI2(g)、bmolH2和cmolHI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
A.平衡向正反应方向移动 B.物质A的转化率增大
C.物质B的质量分数增加 D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+Y═M+N为放热反应,对该反应的说法正确是( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因为该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率可以使用如下方法( )
A. 加H2O B. 加入饱和食盐水
C. 增大压强 D. 升高温度(不考虑盐酸挥发)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在溶液中一定能大量共存的是( )
A. PH=2的溶液:K+、Na+、CH3COO﹣、CO32﹣
B. 与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3﹣、NO3﹣
C. 使酚酞呈红色的溶液中:Na+、K+、SiO32﹣、AlO2﹣
D. FeBr2溶液中滴加KI淀粉溶液变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X(g)+Y(g)⇌R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内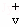 (X)=0.005mol/(L•s).下列说法正确的是( )
(X)=0.005mol/(L•s).下列说法正确的是( )
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应R(g)+Q(g)⇌X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体:CO2+OH﹣=HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E都是含氮元素的化合物,有下列几个反应(未配平):
①A+O2→C ②C+H2O→A+B ③D+O2→A+H2O ④A+C+NaOH→E+H2O写出上述五种化合物的分子式:
A是 ,B是 ,C是 ,D是 ,E是
(2)某同学写出下面四个不同价态的氮的化合物相互转换的关系(未配平):
A.NO+HNO3→N2O3+H2O
B.NH3+NO→HNO2+H2O
C.N2O4+H2O→HNO3+HNO2
D.NH3+HNO2→N2+H2O
其中你认为一定不可能实现的是 (填字母编号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com