
����Ŀ��ijС�����о�ǰ18��Ԫ��ʱ���֣����ݲ�ͬ�ı����ɣ�Ԫ�����ڱ��в�ͬ��������ʽ����������ǰ�ԭ������������˳�����У����γ�ͼ����ʾ������ţ����״��ͼ��ÿ������������һ��Ԫ�أ�����P�������Ԫ�ء�
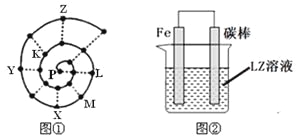
��1��XԪ���ڳ������ڱ��е�λ�� �������ں��壩��
��2��д��M��Z����Ԫ���γɵĻ�����ĵ���ʽ ��
��3������˵����ȷ����_______
a��ZԪ�ض�Ӧ���⻯���KԪ�ض�Ӧ���⻯��е��
b������������Ԫ�ش���ͬһ����
c��K��L��X����Ԫ�ص����Ӱ뾶��С˳����X3+��L +��K 2
d����K��L����Ԫ����ɵĻ������п��ܺ��й��ۼ�
��4��ͼ��װ�ÿ���ģ������ĸ�ʴ������һ���ĵ缫��Ӧʽ�� ������ͼ����Һ�еμ�������̪��Һ�����е�⣬����Fe�缫������Һ��죬д���õ��ص����ӷ���ʽ _�������������������������õ��� _ԭ������������������ԭ���������
���𰸡���1����������IIIA��(1�֣�
��2��![]() ��3��d
��3��d
��4��Fe-2e-=Fe2+(2�֣���2Cl-+2H2O![]() H2��+Cl2��+2OH-(2�֣���ԭ���
H2��+Cl2��+2OH-(2�֣���ԭ���
�����������������P�������Ԫ�أ�����ԭ��������С���������������죬�������ӵ�ԭ�Ӵ���ͬ�壬��ͼ��֪��LΪNa��MΪMg��XΪAl��YΪP��KΪO��ZΪCl��
��1��XԪ����AlԪ�أ�Al��ԭ��������13��λ��Ԫ�����ڱ��ĵ������ڵ���A�壻
��2��M��MgԪ�ء�Z��ClԪ�أ�����ͨ����ʧ�����������ӻ������Ȼ�þ�������ʽΪ![]() ��
��
��3��a��ˮ���Ӽ������������ˮ�ķе�����Ȼ��⣬Aa��b������������Ԫ�ش���ͬһ�壬��������ԽԶ����ԭ�Ӱ뾶Խ��b��ȷ��c�����Ӳ���Խ�������Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���������Ӱ뾶��С����˳��ΪX3+��L+��K2����c����d����K��L����Ԫ����ɵĻ����������Na2O��Na2O2�����������д������Ӽ����ۼ���d��ȷ����ѡbd��
��4��L��Na��Z��ClԪ�أ�LZ��Һ��NaCl��Һ�����������£�������������ʴ��Fe��������C����������������ʧȥ�õ��ӷ���������Ӧ���缫��ӦʽΪFe-2e-= Fe2+������ͼ����Һ�еμ�������̪��Һ�����е�⣬����Fe�缫������Һ��죬��Fe��������C�������������������ӷŵ����������������������ӷŵ����������������ܷ�ӦʽΪ2Cl-+ 2H2O![]() H2��+ Cl2��+ 2OH-�������������������������õ�ԭ����ԭ���ԭ����
H2��+ Cl2��+ 2OH-�������������������������õ�ԭ����ԭ���ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�ѹǿ�£��ϳɰ���Ӧ�ﵽƽ��ʱ�����в�������ʹƽ�ⷢ���ƶ�����
A�����¡���ѹʱ���백�� B�����¡�����ʱ���뵪
C�����¡�����ʱ���뺤�� D�����¡���ѹʱ���뺤��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ���������̬����X��Y��Ӧ������̬����Z�����ǵ����ʵ�����ʱ��ı仯�����ʾ��
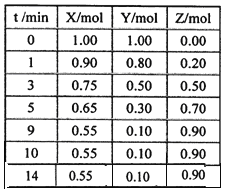
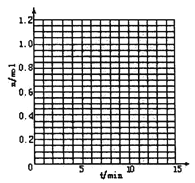
��1�����ݱ������ݣ���ͼ�л���X��Y��Z�����ʵ���(n)��ʱ�䣨t���仯�����ߣ�
��2����ϵ�з�����Ӧ�Ļ�ѧ����ʽ��_____________��
��3����ʽ����÷�Ӧ��0��3minʱ���ڲ���Z��ƽ����Ӧ���ʣ�___________��
��4���÷�Ӧ�ﵽƽ��ʱ��Ӧ��X��ת����������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȡ����Ӧ����
A. �Ҵ���������Ӧ������ȩ B. ������������Ӧ���ɶ��ȼ���
C. ����������Ӧ���ɻ����� D. ��ϩ��ˮ��Ӧ�����Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A��SO32����NO2�� B��NO3����SO3
C��H3O+��ClO3�� D��PO43����SO32��
��CaF2�ľ�����ͼ��ʾ��
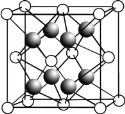
�������й�CaF2�ı�����ȷ����______________��
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c�����������ӱ�Ϊ2:1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ����ԭ����________________________ (�����ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ�����)��
��������F������λ����_________����һ��Ca2+�Ⱦ����������Ca2+��_______����
��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJ��mol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ ��
��ͭ�ĵ�һ������(I1)С��п�ĵ�һ�����ܣ���ͭ�ĵڶ�������(I2)ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о����ʵ����ʾ�����Ҫ���塣��ش��������⣺
��1������ƽ���»�ѧ����ʽ��
_______Al��_______NaNO3��_______NaOH��_______NaAlO2��_______N2����_______H2O
����Ӧ������ת��5 mol���ӣ������ɱ�״����N2�����Ϊ___________L��
��2��25��ʱ����a mol��L-1�İ�ˮ��0.1mol��L-1������������ϣ�����Һ������Ũ�ȹ�ϵ����c��NH4+����c��Cl-��ʱ����Ӧ���������Ϊ_____________��
a������㣬��ˮʣ�� b����ˮ������ǡ����ȫ��Ӧ c���������
��3����NH4HSO4��Һ�еμ�������Ba��OH��2��Һ�����ӷ���ʽ_______________��
��4��25�棬������ĵ���ƽ�ⳣ�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3��10-2 | 6.3��10-8 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
HSO3-�ĵ���ƽ�ⳣ������ʽK=_________��
0.10 mol��L-1 Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ_________��
H2SO3��Һ��NaHCO3��Һ��ϣ���Ҫ��Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���K+��OH����CO32-����Һ�л����ܴ������ڵ�������
A. NH4+ B. Al3+ C. Ca2+ D. SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӻ�Ϊ�ȵ��������
A��NO��O2B��CH4��NH4+C��NH2��H2O2D��HCl��H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com