
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)锡在周期表中的位置为_____________.
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备步骤如下:
I.SnCl2加入盐酸和Sn 粉
II.分离滤渣和滤液
Ⅲ.滤液用NaHCO3调节pH至6~7 得混合物(含SnO)
Ⅳ.从混合物中分离得SnO
V.SnO和稀硫酸最终得SnSO4晶体
①步骤Ⅰ加入Sn粉的作用: _________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:_________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是_____________________,证明已洗净。
⑤步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
(3)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是__________。
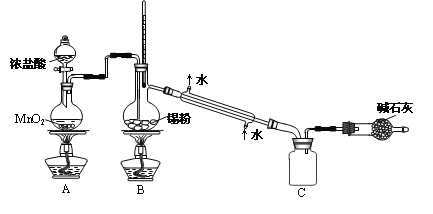
(4)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_________________。
(5)用于微电子器件生产的锡粉纯度测定:
①取2.38g试样溶于较浓硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1000mol/LK2Cr2O7溶液滴定,消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是:__________;此锡粉样品中锡的质量分数:____________。
【答案】(1)第五周期IVA族;
(2)①防止Sn2+被氧化为Sn4+;
②漏斗(或普通漏斗)、玻璃棒;
③Sn2++2HCO3-=SnO+2CO2↑+H2O;
④取最后一次洗涤后滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤蒸发浓缩、冷却结晶;
(3)SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;
(5)将Sn2+全部氧化为Sn4+;30%;
【解析】试题分析:(1)锡是碳族元素,位于周期表的第五周期IVA族,故答案为:第五周期IVA族;
(2)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等.
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化; 故答案为:防止Sn2+被氧化;
②步骤Ⅱ是过滤,用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,故答案为:漏斗、玻璃棒;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净,故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故答案为:蒸发浓缩、冷却结晶;
(3)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
(4)熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行,故答案为:熔融锡与氯气化合的反应是放热反应,且放出的热足够使此反应持续进行;
(5)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
2.38g×x 0.100mol/L×0.02L
故3×119g:2.38g×x=1mol:0.100mol/L×0.02L,
解得x=30%,故答案为:将Sn2+全部氧化为Sn4+;30%.


科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
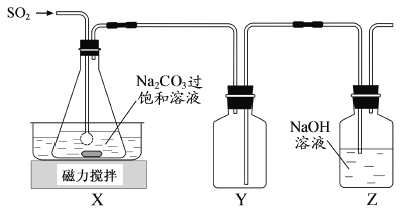
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3=Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是 ( )
A. K+、HCO3-、CO32-、Br- B. SO32-、HSO3-、OH-、K+
C. Fe3+、Cu2+、NO3-、SO32- D. H+、Na+、NO3-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
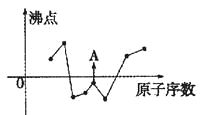
【题目】(1)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
(2)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(3)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)很多金属盐都可以发生焰色反应,其原因是
(5) 已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为缓释阿司匹林的主要成分。用于内燃机润滑油的有机物Y 和用于制备水凝胶的聚合物P 的合成路线如下。

已知:
(1)D 的分子式为C7H6O3,D 中所含的官能团是 。
(2)D→Y的化学方程式是 。
(3)反应Ⅰ的另一种产物是M,其相对分子质量是60,B 、M 均能与NaHCO3反应产生CO2。
①M 是 。
②B→D的化学方程式是 。
(4)下列说法正确的是 。
a.B、C、D中均含有酯基
b.乙二醇可通过![]() 的路线合成
的路线合成
c.C能与饱和溴水反应产生白色沉淀
(5)红外光谱测定结果显示,E 中不含羟基。
①X→E的反应类型是 。
② E的结构简式是 。
(6)若X的聚合度n=1,有机物A 只存在一种官能团,A 的结构简式是 。
(7)聚合物P的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:
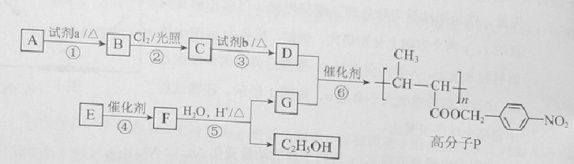
(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO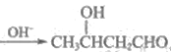 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子组成上相差一个或若干个CH2原子团的有机物一定是同系物
B.具有相同的通式且相差一个或若干个CH2原子团的有机物一定是同系物
C.互为同系物的有机物分子结构必然相似
D.互为同系物的有机物不一定具有相同的通式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质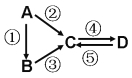 。它们之间有如下的反应关系:
。它们之间有如下的反应关系:
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com