
【题目】若将少量铝粉加入某溶液中,有氢气放出,则该溶液中一定能够大量共存的离子组是:( )
A.K+、Na+、![]() 、Cl-B.
、Cl-B.![]() 、Al3+、Cl-、
、Al3+、Cl-、![]()
C.K+、Na+、[Al(OH)4]-、![]() -D.Na+、K+、
-D.Na+、K+、![]() 、Br-
、Br-
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A. 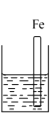 B.
B. 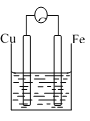 C.
C. 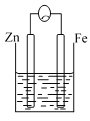
(1)A中反应的离子方程式为_____,B中Cu极电极反应式为______。
(2)C中被腐蚀的金属是____________,总反应方程式为____________,
(3)A、B、C中铁被腐蚀的速率,由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO![]() 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1molL-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1molL-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B.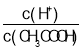 C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]() E.
E.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1molL-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。

①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
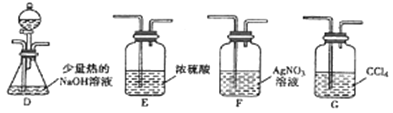
①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:
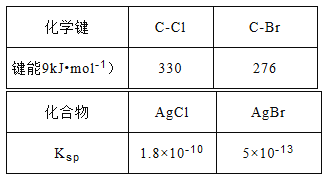
将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
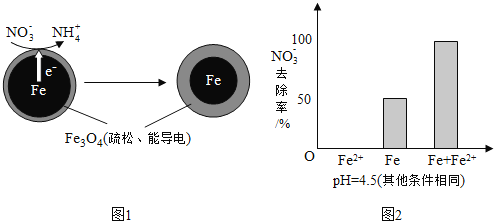
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
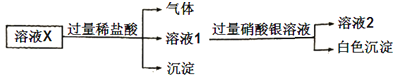
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
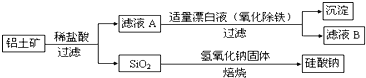
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com