
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成.
A.用活性炭去除冰箱中的异味,是利用活性炭的吸附作用;
B.用热碱水清除炊具上残留的油污,是油脂在碱性条件下的水解;
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果,催熟的乙烯被高锰酸钾氧化;
D.铁粉具有还原性,能和氧气反应,防止食品被氧化.
解答 解:A.用活性炭去除冰箱中的异味:利用活性炭的吸附作用,属于物理变化,没有发生化学变化,故A正确;
B.用热碱水清除炊具上残留的油污:油脂在碱性条件下发生较为彻底的水解反应,属于化学变化,故B错误;
C.乙烯具有催熟作用,为了延长水果的保鲜期,用高锰酸钾可以除掉乙烯,该过程中乙烯与高锰酸钾反应氧化还原反应,属于化学变化,故C错误;
D.硅胶具有吸水性,可以做干燥剂,吸收水分,属于物理变化;铁粉具有还原性,防止食物被氧化,发生氧化还原反应,属于化学变化,故D错误;
故选A.
点评 本题考查了化学变化与物理变化的区别,判断依据是:是否有新物质的生成,题目难度不大,该题各个选项与现实生活接触紧密,比较新颖,注意相关知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
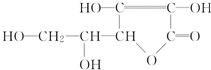 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O与C2H4O2 | B. | C4H10与C4H6O | C. | CF2Cl2与C2F2Cl2 | D. | C4H10与C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| D. | 检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
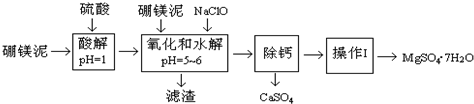
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com