
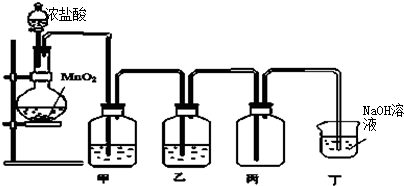
| ||
| ||
| ||


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| 混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 液态氯气 | 苛性钠 | 硫酸铜 | 氧化铁 | 二氧化碳 |
| B | 氯水 | 烧碱 | 食盐 | 氧化钠 | 氧化铝 |
| C | 84消毒液 | 纯碱 | 石灰石 | 氨气 | 水 |
| D | 漂白粉 | 熟石灰 | 苏打 | 生石灰 | 二氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

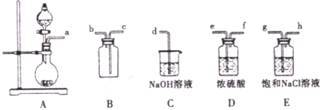
| 实验序号 | 实验操作 | 现象 |
| 甲 | 将氯水滴入品红溶液 | ① |
| 乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-) |
| D、pH=2和pH=1的硝酸中c(H+)之比为1:10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com