
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
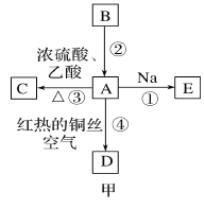
(1)写出B的结构简式________;A中官能团的名称为________。
(2)验证有机物乙酸中含有![]() 所用的试剂是_______,实验现象是_______。
所用的试剂是_______,实验现象是_______。
(3)写出下列反应的化学方程式:
反应①______________;
反应④______________。
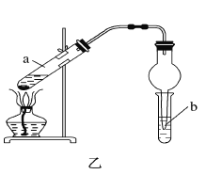
(4)实验室利用反应③制取C,常用上图乙装置:
①a试管中主要反应的化学方程式为_________。反应类型是________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中观察到的现象是__________。
【答案】![]() 羟基
羟基 ![]() 溶液或石蕊溶液 产生气泡或溶液变红
溶液或石蕊溶液 产生气泡或溶液变红 ![]()
![]()
![]() 取代(或酯化)反应 防止倒吸 液体分为两层,上层为透明的油状液体,有香味
取代(或酯化)反应 防止倒吸 液体分为两层,上层为透明的油状液体,有香味
【解析】
B的产量可衡量一个国家石油化工发展的水平,B为CH2═CH2,A是化学实验中常见的有机物,它易溶于水并有特殊香味,结合图中转化可知,A为CH3CH2OH,CH3CH2OH与Na反应生成E为CH3CH2ONa,CH3CH2OH与乙酸反应生成C为CH3COOCH2CH3,A发生催化氧化反应生成D为CH3CHO。
(1)B为乙烯,它的结构简式为CH2═CH2,A为乙醇,结构简式为CH3CH2OH,A中官能团名称为羟基;故答案为:CH2═CH2;羟基。
(2)乙酸中含有—COOH,呈酸性,用石蕊试剂即可检验,若石蕊试剂变红,则证明乙酸中含有—COOH;或用![]() 溶液,现象为产生气泡;故答案为:
溶液,现象为产生气泡;故答案为:![]() 溶液或石蕊溶液;产生气泡或溶液变红;
溶液或石蕊溶液;产生气泡或溶液变红;
(3)反应①乙醇和钠反应生成乙醇钠和氢气,化学方程式:![]() ;乙醇和氧气在铜作催化剂、加热的条件下,发生氧化反应生成乙醛和水,反应④化学方程式:
;乙醇和氧气在铜作催化剂、加热的条件下,发生氧化反应生成乙醛和水,反应④化学方程式:![]() 。故答案为:
。故答案为:![]() ;
;![]() ;
;
(4)①乙醇、乙酸在浓H2SO4加热的条件下发生化学反应,生成乙酸乙酯和水,化学方程式为:![]() ,反应类型为酯化(取代)反应;故答案为:
,反应类型为酯化(取代)反应;故答案为:![]() ;酯化(取代)反应;
;酯化(取代)反应;
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是防止倒吸;故答案为:防止倒吸;
③蒸馏出的乙酸乙酯中含有乙酸、乙醇,通常用饱和碳酸钠溶液,除去挥发出来的乙酸和乙醇,乙酸乙酯不溶于水,密度比水小,液体分层(有香味);故答案为:液体分为两层,上层为透明的油状液体,有香味。


科目:高中化学 来源: 题型:
【题目】SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol-1。已知:反应速率![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

下列说法正确的是( )
A.343K时反应物的平衡转化率为21%
B.a点的反应速率小于b点的反应速率
C.343K时![]() =
=![]()
D.由323K的平衡转化率数据,不能计算323K的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子: 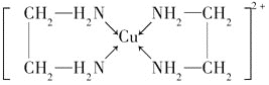 。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在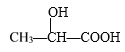 分子中含有2个手性C原子
分子中含有2个手性C原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用苯、浓H2SO4和浓HNO3 制备硝基苯的实验装置如图所示,发生反应方程式:![]() +HO-NO2→
+HO-NO2→![]() +H2O,下列说法错误的是
+H2O,下列说法错误的是

A.反应中浓H2SO4 的作用是催化剂、脱水剂
B.温度计的作用是测水浴的温度,长导管的主要作用是平衡气压
C.实验制得的硝基苯处于混合液的下层
D.从试管内混合物中分离出硝基苯可将反应后的混合物倒入水中,再分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
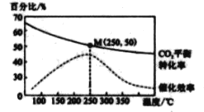
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com