
| A. | 钠、硅、硫等元素在自然界中只存在化合态 | |
| B. | 纯铁的抗腐蚀性能比生铁好 | |
| C. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 | |
| D. | 制备FeCl3不能采用将其溶液直接蒸干的方法 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中有三聚氟化氢(HF)3分子存在 | |
| B. | 冰的密度比液态水的密度小 | |
| C. | H2O的分解温度比H2S高 | |
| D. | 乙醇能与水以任意比混溶而甲醚(CH3-O-CH3)难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 |  | 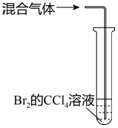 |  |  |
| 目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 7.2 | 5.9 |
| 沉淀完全的pH | 3.3 | 9.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料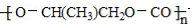 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱 | |
| B. | 熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 | |
| C. | NCl3分子中所有的原子均为8电子稳定结构 | |
| D. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内气体的密度不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为2:1 | |
| D. | 混合气体的质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com