
【题目】一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
① 该反应的平衡常数表达式为____________。
② 若容器容积不变,下列措施可增加甲醇产率的是___________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

① 检验电解时产生的CO2气体,井穴板穴孔内应盛放___________溶液。
② 写出净化甲醇的离子方程式______________________。
【答案】K= ![]() BD △H=—246.1 澄清石灰水 6Co3++CH3OH + H2O=CO2↑+6 Co2++6H+
BD △H=—246.1 澄清石灰水 6Co3++CH3OH + H2O=CO2↑+6 Co2++6H+
【解析】
(1)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①检验二氧化碳应用澄清石灰水检验;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+.
(1)①CO(g)+2H2(g)![]() CH3OH(g)△H<0,反应的平衡常数K=
CH3OH(g)△H<0,反应的平衡常数K=![]() ;
;
②反应是气体体积减小的放热反应,若容器容积不变,下列措施可增加甲醇产率:
A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,分压不变,平衡不移动,故C错误;
D.再充入1mol CO和3mol H2 ,反应物浓度按比例增大,相当于增大压强,平衡正向进行,甲醇产率增大,故D正确;
故答案为:BD;
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
依据盖斯定律计算①×2+②+③得到:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H=-246.1KJ·mol-1;
CH3OCH3(g)+CO2(g)的△H=-246.1KJ·mol-1;
(3)①检验电解时产生的CO2气体,用澄清石灰水检验二氧化碳的存在,井穴板穴孔内应盛放澄清石灰水;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。


科目:高中化学 来源: 题型:
【题目】将0.23 g金属钠投入到100 mL水中,使其充分反应,假设反应后溶液的体积不变。试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
_____________________________________________
(2)产生标准状况下的气体多少毫升?
________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为: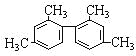 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.分子中至少有16个碳原子处于同一平面上
D.该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是:( )
A.加入合金的质量不可能为6.4g
B.沉淀完全时消耗NaOH溶液的体积为120mL
C.溶解合金时收集到NO气体的体积在标准状况下为2.24L
D.参加反应的硝酸的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:柠檬烯![]()
①将12个橙子皮剪成细碎的碎片,投人乙装置中,加入约30mL水,
②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧, 打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。下列说法不正确的是
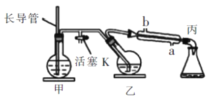
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.为达到实验目的,应将甲中的长导管换成温度计
C.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
D.要得到纯精油,还需要用到以下分离提纯方法:分馏、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛(![]() )是一种食用香精,广泛应用丁牙膏、糖果及调味品中。苯甲醛和乙醛生成肉桂醛过程如下:下列说法正确的是( )
)是一种食用香精,广泛应用丁牙膏、糖果及调味品中。苯甲醛和乙醛生成肉桂醛过程如下:下列说法正确的是( )
Ⅰ.![]() +CH3CHO
+CH3CHO![]()
Ⅱ.![]() +H2O
+H2O
A.1molCH3CHO和环氧乙烷(![]() )混合物中含共用电子对数目为7NA
)混合物中含共用电子对数目为7NA
B.肉桂醛和苯甲醛互为同系物
C.肉桂醛中所有原子不可能在同一平面上
D.检验乙醛中是否有肉桂醛的方法:加入溴水,看是否褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:

下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3A1F6)白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na2AlF6的装置图如下(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑

(1)实验仪器不能使用玻璃仪器的原因是_____________(用化学方程式表示)。
(2)装置III的作用为______________________。
(3)在实验过程中,装置II中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子反应方程式:__________________。
(4)在实验过程中,先向装置II中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和A1(OH)3混合后再通入HF气体,其原因是_______________。 .
(5)装置II反应后的混合液经过过滤可得到Na3A1F6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是_____________________。
(6)在电解制铝的工业生产中,阳极的电极反应式为_____________。
(7)萤石中含有少量的Fe2O3杂质,可用于装置I反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0 g萤石加入装置I中,完全反应后,将混合液加稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定,当出现_________现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为______________。(已知:I2+2S2O32-==S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的日常生活密切相关,下列叙述正确的是![]()
A.水玻璃可用于生产黏合剂和防火剂
B.纤维素、油脂是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.棉、麻、合成纤维完全燃烧都只生成![]() 和
和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com