
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键??? b.氢键??? c.金属键??? d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中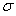 键与
键与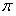 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
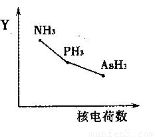
a.稳定性??????? b.沸点?????? c.R—H键能?????? d.分子间作用力
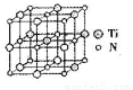
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
(1)[Ar]3d6(2分) (2)F>O>As(1分)
(3)①ad(2分,漏选扣1分,错选不得分) ②sp(1分)? 1:1(1分)
(4)FeF3为离子晶体,FeCl3为分子晶体(2分,答案合理即可得分)
(5)①ac(2分,漏选扣1分,错选不得分)? ②Ti4CN3(2分)
【解析】
试题分析:(1)亚铁离子的核外电子数是24,因此根据核外电子的排布规律可知,基态Fe2+的核外电子排布式为[Ar]3d6。
(2)非金属性越强,电负性越大,则根据元素周期律可知氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As。
(3)①(NH4)3FeF6是离子化合物,存在的微粒间作用力除共价键外还有离子键,另外还有配位键,即N和H、Fe与F之间存在配位键,答案选ad。
②已知SCN一中各原子最外层均满足8电子稳定结构,则碳元素分别与S以及N元素形成1个双键,不存在孤对电子,因此C原子的杂化方式为sp杂化;由于单键都是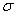 键,双键是由1个
键,双键是由1个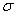 键与1个
键与1个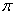 键构成的,则该原子团中
键构成的,则该原子团中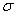 键与
键与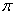 个数的比值为1:1。
个数的比值为1:1。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,这说明氯化铁形成的晶体是分子晶体,而FeF3晶体熔点高于1000oC,这说明氟化铁形成的晶体类型是离子晶体,因此两种化合物熔点差异较大的原因是FeF3为离子晶体,FeCl3为分子晶体。
(5)①a.非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c .非金属性越强与氢元素形成的共价键越强,键能越大,因此R—H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,答案选ac。
②根据晶胞的结构特点并依据均摊法可知,晶胞中含有的碳原子数是8×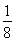 =1,氮原子数6×
=1,氮原子数6×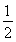 =3,钛原子数是12×
=3,钛原子数是12×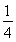 +1=4,所以化学式为Ti4CN3。
+1=4,所以化学式为Ti4CN3。
考点:考查核外电子排布、电负性、作用力、共价键、晶体类型与性质以及晶胞结构的判断与计算等


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com