
| A | C | |
| B |
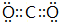 .
.分析 由三种短周期A、B、C在元素周期表中的位置可知,A、C处于第二周期、B处于第三周期,设A原子的最外层电子数为x,根据A、B、C三元素在元素周期表中的位置,则B原子最外层电子数为x+1,C的原子最外层电子数为x+2,又A、B、C 三种元素的原子最外层电子数之和为15,则:x+x+1+x+2=15,解得:x=4,所以A为C元素,B为P元素,C为O元素,据此进行解答.
解答 解:由三种短周期A、B、C在元素周期表中的位置可知,A、C处于第二周期、B处于第三周期,设A原子的最外层电子数为x,根据A、B、C三元素在元素周期表中的位置,则B原子最外层电子数为x+1,C的原子最外层电子数为x+2,又A、B、C 三种元素的原子最外层电子数之和为15,则有x+x+1+x+2=15,解得x=4,所以A为C元素,B为P元素,C为O元素,
(1)由上述分析可知,B的元素符号为P;A元素的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,其结构式为O=C=O,电子式为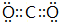 ,
,
故答案为:P;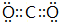 ;
;
(2)C为O元素,C元素的氧化物双氧水可用于实验室中制取O2,其化学式为H2O2,
故答案为:H2O2;
(3)A为C元素,其氢化物为甲烷,甲烷是天然气的主要成分,甲烷在光照条件下与Cl2发生取代反应生成产物有:一氯化碳、二氯化碳、三氯化碳、四氯化碳及HCl,总共有5种产物,
故答案为:5;
(4)C为O元素,其气态氢化物为H2O(g),A的单质为C,碳与水在高温下反应生成CO和氢气,反应的化学方程式为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,(3)为易错点,注意甲烷与氯气的产物包括HCl.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
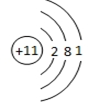 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.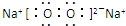 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
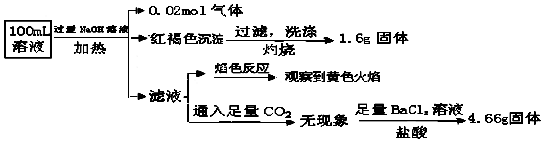
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是( )| A. | 该反应的平衡常数表达式为:K=$\frac{{C}_{(C)}}{{{C}^{2}}_{(A)}•{C}_{(B)}}$ | |
| B. | 0~4 min时,A的平均反应速率为0.01 mol/(L•min) | |
| C. | 由T1向T2变化时,v正>v逆 | |
| D. | 平衡后升高温度,K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com