
| A. | 气态水液化 | B. | 酒精燃烧 | ||
| C. | 碳酸钙高温分解 | D. | 氢氧化钡与氯化铵反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A、气态水液化不是放热反应,是放热的物理过程,故A错误;
B、所有的燃烧均为放热反应,故酒精的燃烧为放热反应,故B正确;
C、绝大多数的分解为吸热反应,故碳酸钙高温分解为吸热反应,故C错误;
D、氢氧化钡与氯化铵反应为典型的吸热反应,故D错误.
故选B.
点评 本题考查放热反应,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
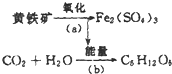 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
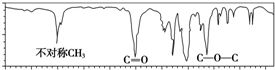
| A. | CH3COOCH2CH3 | B. | CH3CH2COOH | C. | HCOOCH2CH2CH3 | D. | (CH3)2CHCH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海带 | B. | 食盐 | C. | 面粉 | D. | 酸奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
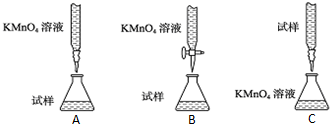
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有1个电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 最外层有3个未成对电子的原子 | D. | 次外层无未成对电子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
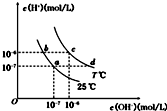
| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com