
| A. | $\frac{a(A-N+m)}{A+m}$mol | B. | $\frac{a(A-N)}{A+m}$ mol | C. | $\frac{a(A-N+m)}{A+2m}$mol | D. | $\frac{a(A-N+m)/}{A}$mol |
分析 根据质子数=质量数-中子数,计算X原子含有的质子数,进而计算每个HmX分子含有质子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有质子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个中子,则质子数为(A-N),则每个HmX分子含有质子数为(A-N+m),ag HmX的物质的量为$\frac{ag}{(2m+A)g/mol}$=$\frac{a}{2m+A}$mol,故含有质子物质的量为$\frac{a}{2m+A}$mol×(A-N+m)=$\frac{a}{2m+A}$(A-N+m) mol,故选C.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.


科目:高中化学 来源: 题型:选择题
| A. | 体积为11.2L | B. | 物质的量为0.5mol | ||
| C. | 含有6.02×1023个分子 | D. | 与1g H2的体积一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
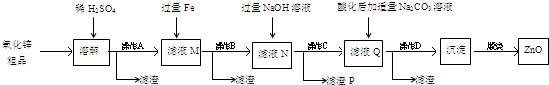
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1盐酸 | B. | 150 mL 2 mol•L-1硫酸 | ||
| C. | 500 mL 3 mol•L-1盐酸 | D. | 500 mL 18.4 mol•L-1浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 B
B E
E
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com