
分析 (1)若要证明“+4价的硫”具有还原性,可选择具有氧化性的试剂;
(2)若要证明“+4价的硫”具有氧化性,可选择具有还原性的试剂,结合发生的反应分析现象,以此来解答.
解答 解:(1)若要证明“+4价的硫”具有还原性,应选用的试剂是①③,发生离子反应为Br2+SO32-+H2O=2Br-+SO42-+2H+,观察到的现象为溴水橙色褪去,
故答案为:①③;溴水橙色褪去;Br2+SO32-+H2O=2Br-+SO42-+2H+;
(2)若要证明“+4价的硫”具有氧化性,应选用的试剂是②③④,发生的离子反应为SO32-+2H+=H2O+SO2、S2-+2H-=H2S、2H2S+SO2=3S↓+2H2O(或2S2-+SO32-+6H+=3S↓+3H2O),观察到的现象为出现浅黄色沉淀(或溶液变浑浊),
故答案为:②③④;出现浅黄色沉淀(或溶液变浑浊);SO32-+2H+=H2O+SO2、S2-+2H-=H2S、2H2S+SO2=3S↓+2H2O(或2S2-+SO32-+6H+=3S↓+3H2O).
点评 本题考查含硫物质的性质及氧化还原反应,为高频考点,把握元素的化合价及发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题

| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
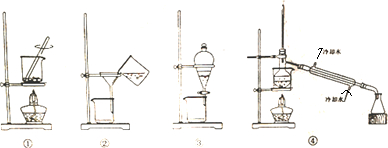
| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应 | |
| B. | CH2=CHCH3+Br2$\stackrel{光照}{→}$CH2=CHCH2Br+HBr;加成反应 | |
| C. | 2CH3CH2OH+O2→2CH3CHO+2H2O;氧化反应 | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr;取代反应 +HBr;取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷, 下列各物质:与麻黄素互为同分异构体的是DE(填字母)
下列各物质:与麻黄素互为同分异构体的是DE(填字母)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com