
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:
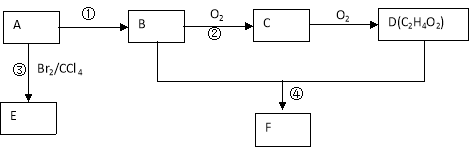
(1)A的结构式为 , D中官能团的名称为 。
(2)反应①的反应类型是 ,反应③的化学方程式为 。
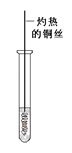
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右上图所示)。重复操作2-3次,观察到的现象是__________。该反应的化学方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。
(5)B、D在浓硫酸的作用下实现反应④,实验装置如右图所示:
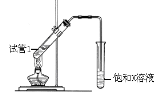
图中X的化学式为_________。浓硫酸的作用是 。
试管Ⅰ中在加热前应加_______,防止液体暴沸。导管末端为伸入小试管液面下的原因是__________。该反应的化学方程式为 。分离产物F的方法是__________。
【答案】(1)![]() 羧基
羧基
(2)加成;CH2=CH2 + Br2→CH2BrCH2Br
(3)铜丝由黑色变红色,产生刺激性气味。
![]()
(4)CH3COOH+HCO3-→CH3COO-+H2O+CO2↑
(5)Na2CO3;催化剂、吸水剂;碎瓷片;防倒吸;
CH3COOH + HOCH2CH3 ![]() CH3COOCH2CH3 +H2O 分液
CH3COOCH2CH3 +H2O 分液
【解析】
试题分析:A是一种气态烃在标准状况下的密度是1.25g/L摩尔质量=1.25g/L×22.4L/mol=28g/mol其产量是衡量一个国家石油化工发展水平则A为CH2=CH2 ;B氧化生成C,C氧化生成D,B和D都是生活中常见的有机物,由D的分子式可知B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯则F为CH3COOCH2CH3,乙烯与溴发生加成反应生成1,2-二溴乙烷;(1)CH2=CH2的结构式为![]() ,CH3COOH中官能团的名称为羧基。
,CH3COOH中官能团的名称为羧基。
(2)反应①是乙烯与水发生加成反应生成乙醇反应;
③是乙烯与溴发生加成反应生成12-二溴乙烷反应,反应③的化学方程式为
CH2=CH2 + Br2→CH2BrCH2Br。
(3)反应②在Cu做催化剂的条件下进行该实验的步骤是将红亮的铜丝置于酒精灯上加热待铜丝变为黑色时迅速将其插入到装有B的试管中(如图2所示).重复操作2-3次观察到的现象是:铜丝由黑色变红色产生刺激性气味该反应的化学方程式为![]() 。
。
(4)CH3COOH与碳酸氢钠溶液反应生成醋酸钠和二氧化碳,离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑。
(5) CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯:利用饱和碳酸钠溶液收集乙酸乙酯,X的化学式为Na2CO3。浓硫酸的作用是催化剂、吸水剂。试管Ⅰ中在加热前应加碎瓷片,防止液体暴沸。导管末端为伸入小试管液面下的原因是防倒吸。该反应的化学方程式为CH3COOH + HOCH2CH3![]() CH3COOCH2CH3 +H2O。乙酸乙酯难溶于水,分离乙酸乙酯的方法是分液。
CH3COOCH2CH3 +H2O。乙酸乙酯难溶于水,分离乙酸乙酯的方法是分液。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中错误的是
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L 的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
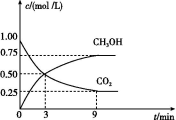
从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
2NH3(g) ΔH = -92.2kJmol—1,测得0到10秒内,c(H2)减小了0.75molL—1,下列说法正确的是( )
A.10到15秒内c(NH3) 增加量等于0.25mol L—1
B.10秒内氨气的平均反应速率为0.025molL—1·s—1
C.达平衡后,分离出少量NH3,v正 增大
D.该反应的逆反应的活化能不小于92.2kJmol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是
A.K+ B.SO42- C.Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如表实验.
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验 内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为 的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是 (填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由 腐蚀造成的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是(设NA表示阿伏伽德罗常数)
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝
B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解
C.足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子
D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
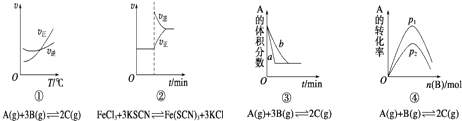
A.①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com