
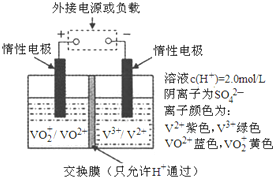
 ����V�����仯����㷺Ӧ���ڹ�ҵ�����²��Ϻ�����Դ������
����V�����仯����㷺Ӧ���ڹ�ҵ�����²��Ϻ�����Դ������
���� ��1���������Һ��������ƣ�VO2+ת��ΪVO2+������������Ӧ��ӦΪ���ص�������
�ڷŵ�����У��Ҳ�Ϊ����������������Ӧ����V2+����V3+��
�۷ŵ�����У��缫��ӦʽΪVO2++2H++e-=VO2++H2O�������ӵ������dz��ʱ������������Ӧ��ͨ������Ĥ�����ƶ�ʹ��Һ�ɵ����ԣ�
�ܳ��ʱ����۷����ķ�ӦΪVO2++H2O-e-=VO2++2H+��ת�Ƶ���2mol����ʱ������������Ϊ2mol��
��2����n��KOH��=2mol/L��1L=2mol����װ����ȼ�ϵ�أ������ϼ���ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ������ԭ���غ��0��n��CO2����1mol��������̼����������Ӧ����̼��أ�
�ڸ���ԭ���غ��2mol��n��CO2����4mol����Ӧ����̼����أ�
�۵�V=67.2Lʱ��n��CO2��=3mol����̼��ص����ʵ���Ϊx��̼����ص����ʵ���Ϊy������Kԭ�ӡ�Cԭ���غ��$\left\{\begin{array}{l}{x+y=3}\\{2x+y=4}\end{array}\right.$�����x=1��y=2����Һ��̼�����̼���������ˮ�⣬��Һ�ʼ��ԣ�̼�������ˮ��̶ȴ���̼��������ӣ�
��� �⣺��1���������Һ��������ƣ�VO2+ת��ΪVO2+������������Ӧ��ӦΪ���ص���������缫��ӦʽΪVO2++H2O-e-=VO2++2H+��
�ʴ�Ϊ��VO2++H2O-e-=VO2++2H+��
�ڷŵ�����У��Ҳ�Ϊ����������������Ӧ����V2+����V3+����Һ��ɫ����ɫ��Ϊ��ɫ���ʴ�Ϊ���ϣ�����
�۷ŵ�����У��缫��ӦʽΪVO2++2H++e-=VO2++H2O�������ӵ������dz��ʱ������������Ӧ��ͨ������Ĥ�����ƶ�ʹ��Һ�ɵ����ԣ��ʴ�Ϊ������������Ӧ��
�ܳ��ʱ����۷����ķ�ӦΪVO2++H2O=VO2++2H++e-����ת�Ƶ���Ϊ1mol����ʱ������������Ϊ2mol����ʱ�����Ӳ����������ƶ���ͨ������Ĥ�����ƶ�ʹ����ͨ����Һ����Һ�����ӵĶ����ƶ����γɵ�����ͨ��1mol���ӣ��������Һ��n��H+���ı仯��Ϊ2mol-1mol=1mol�����Բ���Һ��n��H+���ı仯��Ϊ2mol����Ӧת�Ƶĵ�����Ϊ2mol��
�ʴ�Ϊ��2mol��
��2����n��KOH��=2mol/L��1L=2mol����װ����ȼ�ϵ�أ������ϼ���ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ������ԭ���غ��0��n��CO2����1mol��������̼����������Ӧ����̼��أ�����ܷ�Ӧ����ʽΪ��CH4+2O2+2KOH=K2CO3+3H2O��
�ʴ�Ϊ��CH4+2O2+2KOH=K2CO3+3H2O��
�ڸ���ԭ���غ��2mol��n��CO2����4mol����Ӧ����̼����أ�������ӦʽΪCH4-8e-+9CO32-+3H2O=10HCO3-��
�ʴ�Ϊ��CH4-8e-+9CO32-+3H2O=10HCO3-��
�۵�V=67.2Lʱ��n��CO2��=3mol����̼��ص����ʵ���Ϊx��̼����ص����ʵ���Ϊy������Kԭ�ӡ�Cԭ���غ��$\left\{\begin{array}{l}{x+y=3}\\{2x+y=4}\end{array}\right.$�����x=1��y=2����Һ��̼�����̼���������ˮ�⣬��Һ�ʼ��ԣ�̼�������ˮ��̶ȴ���̼��������ӣ�������Һ������Ũ�ȴ�С˳��Ϊ��c��K+����c��HCO3-����c��CO32-����c��OH-����c��H+����
�ʴ�Ϊ��c��K+����c��HCO3-����c��CO32-����c��OH-����c��H+����
���� ���⿼���Ϊ�ۺϣ��漰ԭ��ء������Լ�����Ũ�ȴ�С�Ƚϵȣ�Ϊ��Ƶ���㣬���ؿ���ѧ����������������ע�����ԭ��ء����صĹ���ԭ����Ϊ������Ĺؼ����Ѷ��еȣ�


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
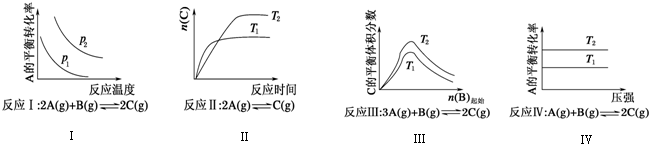
| A�� | ��Ӧ��H��0��p2��p1 | B�� | ��Ӧ��H��0��T2��T1���H��0��T2��T1 | ||
| C�� | ��Ӧ��H��0��T1��T2 | D�� | ��Ӧ������H��0��T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
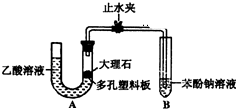 ijУѧ��С��Ϊ̽�����ᡢ̼��ͱ��ӵ�����ǿ����֤������Ϊ���ᣬ��������ʵ�飮̽�����ᡢ̼��ͱ��ӵ�����ǿ����ϵ��Уѧ���������ͼ��ʵ��װ�ã��г���������ȥ����
ijУѧ��С��Ϊ̽�����ᡢ̼��ͱ��ӵ�����ǿ����֤������Ϊ���ᣬ��������ʵ�飮̽�����ᡢ̼��ͱ��ӵ�����ǿ����ϵ��Уѧ���������ͼ��ʵ��װ�ã��г���������ȥ���� -ONa��Һ��pH����pH�ɴ�С���е�˳��Ϊbdac��������Һ��ţ�
-ONa��Һ��pH����pH�ɴ�С���е�˳��Ϊbdac��������Һ��ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | |||||||
| B | C | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
��| ʵ������ | ԭ�� |
| ��Һ�������ɫ��Ϊ��ɫ | ������ˮ��Ӧ���ɵ�H+ʹʯ���ɫ |
| �����Һ��Ϊ��ɫ | _������ˮ��Ӧ���ɵ�HClO��ʯ������Ϊ��ɫ���� |
| Ȼ����Һ����ɫ��Ϊdz����ɫ | ����ͨ�����������ˮʹ��Һ��dz����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
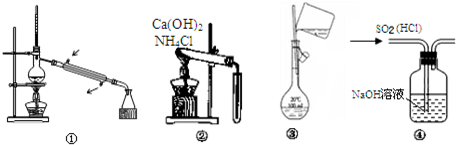
| A�� | ͼ�ٳ����ڷ���е㲻ͬ�ұ˴˻��ܵ�Һ̬����� | |
| B�� | ͼ�ڿ�����ʵ�����Ʊ����ռ�������NH3 | |
| C�� | ͼ�۱�ʾ����ʵ����������Һת�ƹ��� | |
| D�� | ͼ�ܿ����ڳ�ȥSO2�е�HCl���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com