
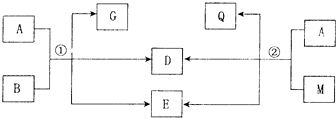
 .
.
分析 Ⅰ.(1)若A是黑色非金属固体单质,则A应为C,根据元素守恒,D中应含有碳元素,D是气体,E是水,则D应为碳的氧化物,由于一氧化碳会和水继续反应,所以D应为二氧化碳;
(2)若A是红色金属,则A应为Cu,B、M是同种溶质不同浓度的溶液,A与B、M都能反应,则B、M为浓硝酸和稀硝酸,G、Q是气体,它们应为NO和NO2,且G可通过化合反应生成Q,则G为NO,Q为NO2,所以B为稀硝酸,M为浓硝酸;
(3)若A是Ca(OH)2,D是极易溶于水的气体,其水溶液显碱性,则D为NH3,若G、Q为同一种物质,当lmolCa(OH)2分别与B、M完全反应时,反应①、②生成的D的物质的量之比为2:1,则B为铵盐,M为酸式铵盐;
Ⅱ.A、B、C、D、E是硫单质或硫的化合物,E和D反应生成硫代硫酸钠,则D和E为硫和亚硫酸钠,B和C生成D,则D应为S,B和C应为H2S和SO2,A由两种元素组成,其中一种为硫元素,其质量比为7:4,设该元素的相对原子为M,该元素与硫元素的原子个数比为x:1,则有xM:32=7:4,所以xM=56,当x=1时,M=56,即该元素为铁元素,A为FeS,FeS与盐酸反应生成B为H2S,FeS与氧气反应生成C为SO2,B和C反应生成S,C与氢氧化钠反应生成亚硫酸钠,符合题意,据此答题.
解答 解:Ⅰ.(1)若A是黑色非金属固体单质,则A应为C,根据元素守恒,D中应含有碳元素,D是气体,E是水,则D应为碳的氧化物,由于一氧化碳会和水继续反应,所以D应为二氧化碳,其电子式为 ,
,
故答案为: ;
;
(2)若A是红色金属,则A应为Cu,B、M是同种溶质不同浓度的溶液,A与B、M都能反应,则B、M为浓硝酸和稀硝酸,G、Q是气体,它们应为NO和NO2,且G可通过化合反应生成Q,则G为NO,Q为NO2,所以B为稀硝酸,M为浓硝酸,反应①的离子方程式是3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)若A是Ca(OH)2,D是极易溶于水的气体,其水溶液显碱性,则D为NH3,若G、Q为同一种物质,当lmolCa(OH)2分别与B、M完全反应时,反应①、②生成的D的物质的量之比为2:1,则B为铵盐,M为酸式铵盐,
故答案为:铵盐;酸式铵盐;
Ⅱ.A、B、C、D、E是硫单质或硫的化合物,E和D反应生成硫代硫酸钠,则D和E为硫和亚硫酸钠,B和C生成D,则D应为S,B和C应为H2S和SO2,A由两种元素组成,其中一种为硫元素,其质量比为7:4,设该元素的相对原子为M,该元素与硫元素的原子个数比为x:1,则有xM:32=7:4,所以xM=56,当x=1时,M=56,即该元素为铁元素,A为FeS,FeS与盐酸反应生成B为H2S,FeS与氧气反应生成C为SO2,B和C反应生成S,C与氢氧化钠反应生成亚硫酸钠,符合题意,
(1)B为H2S,H2S分子的空间构型为V形,
故答案为:V形;
(2)反应2为FeS与氧气的反应,化学方程式为4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2,
故答案为:4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2;
(3)反应3为二氧化硫和硫化氢的反应,化学方程式为2H2S+SO2═3S+2H2O,反应生成3molS转移4mol电子,所以生成1molS时电子转移数为4/3NA,
故答案为:2H2S+SO2═3S+2H2O;4/3NA;
(4)氯气通入硫代硫酸钠溶液中发生氧化还原反应,将硫代硫酸根氧化成硫酸根,反应的离子方程式为S2O32-+4Cl2+5H2O═10H++8Cl-+2SO42-,
故答案为:S2O32-+4Cl2+5H2O═10H++8Cl-+2SO42-;
(5)若把SO2通入到亚硫酸钠的饱和溶液中会析出另一种晶体--焦亚硫酸钠,根据元素守恒可知,焦亚硫酸钠的化学式为Na2S2O5,焦亚硫酸钠在空气中已被氧化得到硫酸根,检验焦亚硫酸钠在空气中已被氧化的实验方案是取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量的盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,则说明Na2S2O5已被氧化,
故答案为:Na2S2O5;取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量的盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,则说明Na2S2O5已被氧化.
点评 本题主要考查元素及其化合物知识,根据反应特征及物质性质进行物质推断是解题的关键,答题时注意元素化合物知识的灵活运用.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. |  可用于NaCl与NH4Cl混合物的分离 | |
| B. |  用于去除Fe(OH)3胶体中含有的可溶性物质 | |
| C. |  橡皮管起到平衡气压、使液体顺利流下的作用 | |
| D. |  若该仪器为酸式滴定管,则表示其内液体体积为5.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3含有的原子数为4NA | |
| B. | 78 g过氧化钠中含有的离子数为4NA | |
| C. | 过氧化钠与CO2反应生成32g O2,则反应转移的电子数为2NA | |
| D. | 密闭容器中,标准状况下22.4L SO2和11.2LO2 在加热、有催化剂的条件下充分反应,容器中的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟少量的饱和石灰水反应2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向氢氧化钠溶液中加入稀醋酸 OH-+H+═H2O | |
| C. | 向氯化铁溶液中加入铁粉 Fe+FeCl3=2Fe2++3Cl- | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| B. | 除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤 | |
| C. | 除去FeC13 酸性溶液中少量的FeC12:加入稍过量双氧水后放置 | |
| D. | 除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸馏烧瓶中应加入碎瓷片防止暴沸 | |
| B. | 温度计水银球必须插在液面以下 | |
| C. | 先点燃酒精灯再通入冷却水 | |
| D. | 精制的食盐水蒸馏后可以获得蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com