
取6根铁钉,6支干净的试管及其他材料,如图所示。

试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已 赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是__________ (填试管序号);在电化学腐蚀中,负极反应是_______________,正极反应是___________________。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_____________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是________________________ _
_
(答两种方法)。
此题是利用原电池形成的条件及原理解释金属腐蚀的速率问题。解答此类题目的关键是根据金属腐蚀的原理、分类和条件对题目进行综合分析。
(1)由于②、③两个试管不具备构成原电池的条件,不能发生电化学腐蚀,所以未被腐蚀。而试管⑤尽管具备构成原电池的条件,但锌比铁活泼,在原电池中作负极,使铁变成亚铁离子的反应难以发生,所以铁也未被腐蚀。发生电化学腐蚀的负极反应为Fe-2e-====Fe2+,正极反应为O2+2H2O+4e-====4OH-。
(2)对比发生电化学腐蚀的试管和未发生电化学腐蚀的试管中铁钉的锈蚀情况,可知引起和促进铁钉腐蚀的条件为水、空气、电解质溶液和不活泼金属杂质的存在。
(3)电镀、发蓝、制成不锈钢、牺牲阳极保护法等都可以保护金属。
答案:(1)①④⑥ Fe-2e-====Fe2+
O2+2H2O+4e-====4OH-
(2)水、空气、电解质溶液和不活 泼金属杂质的存在
泼金属杂质的存在
(3)在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法(答出其中两种即可)


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
25 ℃时,将1 mol/L的醋酸钠溶液用水稀释至0.1 mol/L,溶液中增大的是( )
A.c(OH-) B.c(CH3COOH) C.  D. c(H+)
D. c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 可用作制冷剂,元素的气态氢化物极易溶于水 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式 。
(2)B元素在周期表中的位置 ;离子半径:B A(填“大于”或“小于”)。
(3)C原子的电子排布图是 ,其原子核外有 个未成对电子,能量最高的电子为 轨道上的电子,其轨道呈 形。
(4)D原子的电子排布式为 ,D-的结构示意图是 。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为 。与D的氢化物的水化物反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向10 mL 0.1 mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是( )
A.x=10时,溶液中有N 、Al
、Al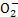 、S
、S ,且c(N
,且c(N )>c(S
)>c(S )
)
B.x=10时,溶液中有N 、Al3+、S
、Al3+、S ,且c(N
,且c(N )>c(Al3+)
)>c(Al3+)
C.x=30时,溶液中有Ba2+、Al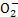 、OH-,且c(OH-)<c(Al
、OH-,且c(OH-)<c(Al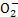 )
)
D.x=30时,溶液中有Ba2+、Al3+、Al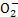 ,且c(OH-)=c(Ba2+)
,且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关钢铁腐蚀说法正确的是( )
A.钢铁腐蚀时铁作正极
B.钢铁腐蚀时铁发生的反应为:Fe-3e-====Fe3+
C.在碱性环境中正极反应式为:O2+2H2O+4e-====4OH-
D.在酸性环境中正极反应式为:O2+4H++4e-====2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列事实得出的结论正确的是( )
A.Na2SO3试样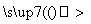
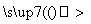 白色沉淀
白色沉淀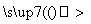 沉淀不溶解 结论:此Na2SO3试样已变质
沉淀不溶解 结论:此Na2SO3试样已变质
B.稀硫酸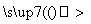 产生气泡的速率较慢
产生气泡的速率较慢 产生气泡的速率明显加快 结论:CuSO4对此反应有催化作用
产生气泡的速率明显加快 结论:CuSO4对此反应有催化作用
C.某溶液 瓶口产生白雾
瓶口产生白雾 瓶口产生白烟 结论:此溶液一定为浓盐酸
瓶口产生白烟 结论:此溶液一定为浓盐酸
D.无色试液 产生无色无味气体
产生无色无味气体 石灰水变浑浊 结论:原无色试液中可能含有CO
石灰水变浑浊 结论:原无色试液中可能含有CO
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是制备和研究乙炔性质的实验装置图。下列说法不正确的是( )

A.制备乙炔的反应原理是CaC2+2H2O―→Ca(OH)2+C2H2↑
B.c的作用是除去影响后续实验的杂质
C.d中的有机产物与AgNO3溶液混合能产生沉淀
D.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列装置不能达到有关实验目的的是( )
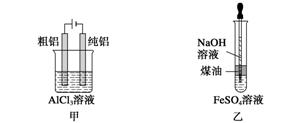

A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.丙图装置酸性KMnO4溶液中出现气泡且颜色逐渐褪去
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验需要100 mL 1 mol·L-1的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用 (填仪器名称)搅拌。
②把①所得溶液冷却到室温后,小心转入 (填仪器名称)。
③继续加蒸馏水至液面距刻度线1 cm~2 cm处,改用 (填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是 (填序号)。
(2)若没有操作④,则所配溶液的浓度会_________(填“偏高”或“偏低”)。
(3)在配制100 mL 1 mol·L-1的Na2CO3溶液时,下列操作中的 会导致结果偏低(请用序号填写)。
①用托盘天平称量时砝码放在左盘,并使用了游码
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com