
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
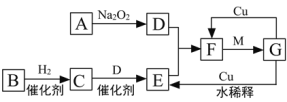
(1)物质G的化学式:__________________。
(2)物质B的名称:____________________。
(3)写出A→D的化学方程式:_______________________________________________;
F→G的化学方程式:______________________________________________________;
G→E的离子方程式:______________________________________________________。
【答案】HNO3 氮气 2CO2 + 2Na2O2 = 2Na2CO3 + O2 3NO2+H2O=2HNO3+NO 3Cu + 8H+ + 2NO3– = 3Cu2+ + 2NO↑+ 4H2O
【解析】
根据题中各物质转化关系可以知道,无色无味气体A与过氧化钠反应的得到气体D,则A为CO2,D为O2,C是使湿润的红色石蕊试纸变蓝的气体,则C为NH3,故B为N2,E为NO,F为NO2,M是最常见的无色液体,应为H2O,由转化关系可以知道G为HNO3,据此答题。
(1)由上述分析可以知道,物质G的化学式为:HNO3,
因此,本题正确答案是:HNO3;
(2)物质B为N2,其名称为:氮气,
因此,本题正确答案是:氮气;
(3) A为CO2,D为O2,CO2和过氧化钠反应生成碳酸钠和氧气,化学方程式:2CO2 + 2Na2O2 = 2Na2CO3 + O2,
因此,本题正确答案是:2CO2 + 2Na2O2 = 2Na2CO3 + O2;
F为NO2,NO2和水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO,
因此,本题正确答案是:3NO2+H2O=2HNO3+NO;
G为HNO3,稀硝酸可与铜反应生成NO,反应的离子方程式为3Cu + 8H+ + 2NO3– = 3Cu2+ + 2NO↑+ 4H2O,
因此,本题正确答案是:3Cu + 8H+ + 2NO3– = 3Cu2+ + 2NO↑+ 4H2O。


科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是

A. 正反应的活化能等于逆反应的活化能
B. a曲线是加入催化剂时的能量变化曲线
C. 1 mo N2与3 mo H2充分反应放出的热量小于92 kJ
D. 加入催化剂,该反应的焓变减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 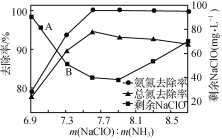 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列常用物质:
A.碳酸氢钠 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄
请用字母填空:
①具有解热镇痛疗效的是________,②可直接进入人体血液补充能量的是________,③可用作食品防腐剂的是________,④常用作食品着色剂的是________,⑤常用作治疗胃酸过多的抗酸剂的是________。
(2)保护环境,人人有责。
①空气质量监测中,不需要监测的指标是_________。
A.可吸入颗粒物的含量 B.NO2浓度 C.SO2浓度 D.CO2浓度
②在处理产生的废水时,需先加入明矾,其作用是____________________________________;后通入氯气或二氧化氯,其作用是____________________________________________。
③汽车尾气需要用催化转化器减少有毒气体排放。写出汽车尾气中CO、NO相互作用生成可参与大气循环的两种气体的化学方程式_________________________________________。
④对垃圾需要分类处理。如图所示的垃圾分类标志的含义是__________________。

(3)化学与材料密切关联。
①石墨烯(如图)可用作太阳能电池的电极,这里主要利用了石墨烯的__________________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是___________________。
③钢铁在酸雨中会发生电化学腐蚀,请举一例钢铁防腐措施_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,下列说法不正确的是
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线。下列叙述错误的是( )

A. t1℃时,三种物质的溶解度大小顺序为C>B>A
B. 当A中混有少量B 时,可用降温结晶的方法提纯A
C. 将A、B、C的饱和溶液从t3℃降温到t2℃,溶液中均有固体析出
D. 若要将N点的A溶液转变为M点的A溶液,可在恒温条件下采用蒸发溶剂法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com