
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:解答题
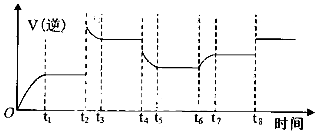
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①的化学方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1 mol Si,转移4 mol 电子 | |
| C. | 二氧化硅能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 1mol Cl2与水充分反应,转移的电子个数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | 18 g H2O含有的电子数为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
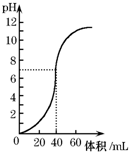 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com