
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 
A.P3<P4 , y轴表示B的体积分数
B.P3<P4 , y轴表示混合气体的密度
C.P3>P4 , y轴表示B的百分含量
D.P3>P4 , y轴表示混合气体的平均摩尔质量
【答案】D
【解析】解:依据图Ⅰ中a、b的相对位置知,先拐先平,压强大p2>p1,增压(因p2>p1),w(C)升高,平衡正向进行故x=1;
由b、c的相对位置知,先拐先平,围堵高,升温(因为T1>T2),w(C)降低,故正反应为放热反应.
即该反应为:A(g)+B(g)C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动.
由图(Ⅱ)知:因随着温度升高y降低,故y降低的方向必为压强减小的方向,则:
A.P3<P4,随着压强的减小,平衡向着逆向移动,则B的体积分数增大,与图象不符合,故A错误;
B.P3<P4,混合气体质量不变,体积不变,密度始终不变,与图象不符合,故B错误;
C.P3>P4,若y轴表示B的百分含量,随着温度升高,平衡向着逆向移动,B的百分含量增大,与图象不会不相符,故C错误;
D.P3>P4,平衡逆移气体总物质的量增大,所以气体的平均摩尔质量减小,与图象变化一致,故D正确;
故选D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知反应:①C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
写出表示CO燃烧热的热化学方程式 .
(2)搭载神舟十一号航天飞船的长征二号F运载火箭的助推器、芯一级、芯二级应用的燃料全部是液态偏二甲肼和液态四氧化二氮.其中偏二甲肼(C2H8N2)为火箭燃料,四氧化二氮(N2O4)为氧化剂,当它们混合时,立即产生大量氮气、二氧化碳和水蒸气,并放出大量热. 若0.1mol 偏二甲肼与N2O4完全反应时,放出 526.65kJ的热量.写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应. 2R﹣C≡C﹣H ![]() R﹣C≡C﹣C≡C﹣R+H2
R﹣C≡C﹣C≡C﹣R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值.下面是利用Glaser反应制备化合物E的一种合成路线: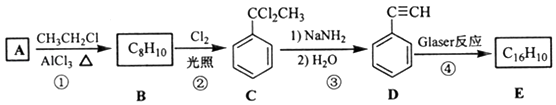
回答下列问题:
(1)B的结构简式为 , D 的化学名称为 .
(2)①和③的反应类型分别为、 .
(3)E的结构简式为 . 用1mol E合成1,4﹣二苯基丁烷,理论上需要消耗氢气mol.
(4)化合物( ![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为 .
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中2种的结构简式 , .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I是重要有机中间体,其合成路线(部分反应条件已略去)如下图所示:

已知:
R — CN![]() R — COOH
R — COOH
回答下列问题:
(1)A的结构简式是______________。
(2)B中含有的官能团是______________。
(3)D是一种合成高分子,它的结构简式是______________。
(4)I发生缩聚反应的化学方程式是______________。
(5)G→H的反应类型是______________。
(6)E→F反应的化学方程式是______________。
(7)下列说法正确的是________。
①物质I能发生消去反应
②F→G过程产生的副产物 物质G互为同分异构体
物质G互为同分异构体
③B、D均存在顺反异构
(8)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)________。(合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素最外层电子数与原子序数的关系图. 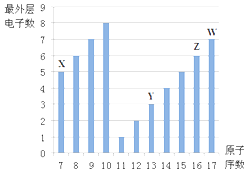
请回答下列问题:
(1)画出Z的原子结构示意图 .
(2)原子半径:YZ(填“>”、“<”).
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为 .
(4)X的最高价氧化物的水化物的化学式为 .
(5)画出W的氢化物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:

(1)判断装置A和B的能量转化形式:A池为______________,B池为_________________。
(2)锌电极发生 _________反应;铜极发生__________________________反应;石墨棒C1为____极,电极反应式为_________;石墨棒C2附近发生的实验现象___________。
(3)当C2极析出44.8 L气体(标准状况下),锌的质量变化为(增加或减少)________g。CuSO4溶液的质量变化为(增加或减少)________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) ![]() 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g)![]() 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=__________
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)![]() 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
温度/K | 298 | 398 | 498 | … |
平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1____K2(填“>”或“<”),其判断理由是_____________。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。

①下列说法正确的是______(填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______。
(5)氮碳比[![]() ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当![]() =_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
=_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若向盛有溶液①和溶液②的试管中,通入过量气体X,最终①、②均有沉淀生成的是

选项 | X | ①溶液 | ②溶液 |
A | Cl2 | Na2SO3 | Na2S |
B | SO2 | Na2SiO3 | Ba(NO3)2 |
C | NH3 | AgNO3 | AlCl3 |
D | HCl | CuSO4 | NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com