
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
分析 A.钾的次外层电子数为8,镁的次外层电子数为8;
B.乙烯和丙烯的最简式均为CH2,由n=$\frac{m}{M}$可知,等质量时含CH2的个数相同;
C.同温、同压、同体积,由n=$\frac{V}{Vm}$可知,气体的物质的量相同;
D.根据反应后钠元素的价态来分析.
解答 解:A.钾的次外层电子数为8,镁的次外层电子数为8,次外层电子数相同,故A正确;
B.乙烯和丙烯的最简式均为CH2,由n=$\frac{m}{M}$可知,等质量时含CH2的个数相同,1个C2H4分子共用6对电子(其中4个C-H,2个C-C),1个C3H6分子共用9对电子(其中6个C-H,3个C-C),因此可以发现规律:1个CH2平均共用3对电子,含CH2的个数相同则共有电子对数相同,故B正确;
C.同温、同压、同体积,由n=$\frac{V}{Vm}$可知,气体的物质的量相同,C、N的质子数不同,则CO和NO含有的质子数不同,故C错误;
D.反应后钠元素的价态为+1价,故1mol钠无论在什么反应条件下均转移1mol电子,故D正确;
故选C.
点评 本题考查物质的量的计算,把握物质的构成、物质的量计算公式、转移电子计算等为解答的关键,侧重分析与应用能力、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 若①②③④四种溶液等体积混合,混合液pH=7,则混合液中c(NH4+)=c(CH3COO-) | |
| B. | ①④两溶液等体积混合,混合液中c(H+)>c(OH-) | |
| C. | ①③溶液中水的电离程度相等 | |
| D. | V1L②和V2L④溶液混合后溶液pH=9,则V1=$\frac{11}{9}$V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
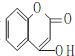 )的路线如下图所示:
)的路线如下图所示: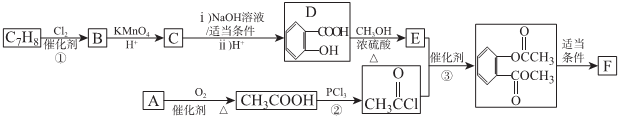
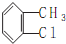 .
. .
.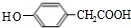 .
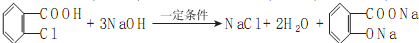
.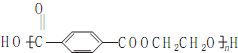 ),参照A→乙酸的表示方法,写出相应的合成路线图
),参照A→乙酸的表示方法,写出相应的合成路线图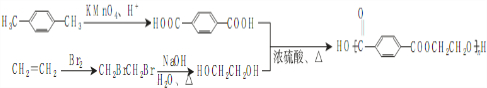 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
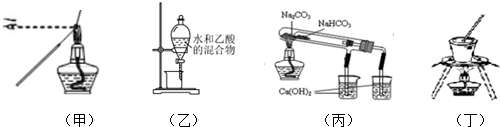
| A. | 甲图装置:用蘸有待测液的铁丝,检验K+ | |
| B. | 乙图装置:分离水和乙酸 | |
| C. | 丙图装置:验证NaHCO3和Na2CO3的热稳定性 | |
| D. | 丁图装置:从食盐水中提取食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
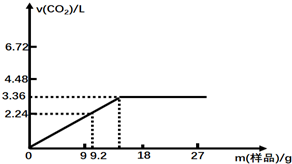
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
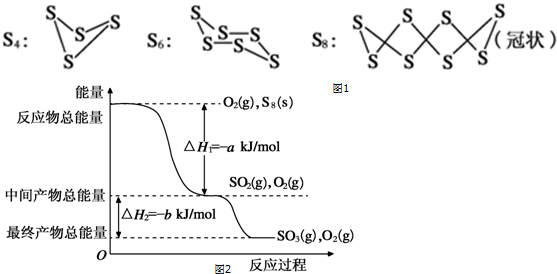
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
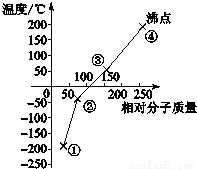
| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
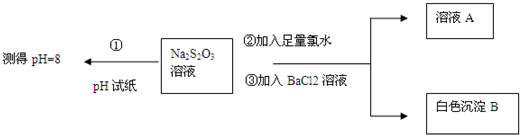
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com