
有以下物质 ① NaNO3溶液 ② 熔融的MgCl2 ③CuSO4粉末 ④ NaOH 固体
⑤ 金属铜 ⑥ 蔗糖。 有关它们的说法正确的是
A. 能导电的有①②③④⑤; B. 属于电解质有①②③④
C. 不能导电的有③④⑥ D. 属于纯净物的只有④⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列表格中的各种情况,可以用下图的曲线表示的是
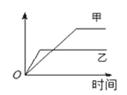
| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量等颗粒大小的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2 molSO2和1 molO2,在相同温度下 2SO2 + O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C.FeCl3+3KSCN 3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动
3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动
D.对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
确认能发生化学平衡移动的是( )
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)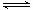 2NO2(g),测得n(NO)随时间的变化如下表:
2NO2(g),测得n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示2s时该反应的平均速率v =__________________。
(2)写出该反应的平衡常数表达式:K=__________________________ ___ 。已知:K(800℃)>K(850℃),该反应是__________(填“吸热”或“放热”)反应。
(3)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体的密度保持不变
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
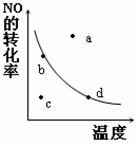
(5)下图中的曲线表示的是其他条件一定时,反应:2NO (g)+O2(g) 2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
A.a点 B.b点
C.c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,离子方程式书写正确的是
A.Fe和盐酸反应:2Fe + 6H+= 2Fe3++3H2↑
B.Cu和AgNO3溶液反应:Cu +Ag+= Cu2++ Ag
C.石灰石和盐酸反应: CO32-+ 2H+ = CO2↑+ H2O
D.氢氧化钡与盐酸反应: OH- + H+= H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,能在强酸性溶液里大量共存,并且溶液呈无色透明的是( )
A.Cu2+、K+、Na+、SO42- B.Mg2+、K+、C1-、NO3-
C.Na+、K+、HCO3-、Cl- D.Ba2+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(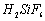 )等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
)等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
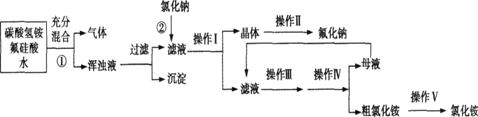
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:
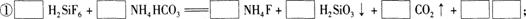
② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:
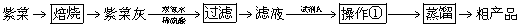
已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
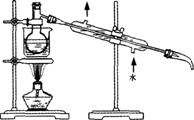
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜
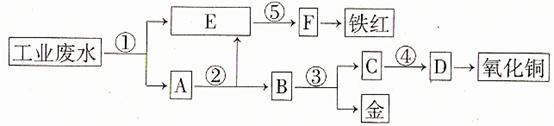
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com