
【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________
【答案】5.3g 500mL容量瓶 BCAFED 偏低 偏高 重新配制
【解析】
(1)依据配制溶液体积选择容量瓶规格,依据m=c·V·M计算需要溶质的质量;
(2)用固体配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签等,据此排序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(4)任何操作导致实验失败且不能补救的都必须重新配制。
(1)配制480mL0.1mol/L的Na2CO3溶液,实验室没有480mL规格容量瓶,应选择500mL容量瓶,则由于溶液具有均一性,溶液的浓度相同,需要溶质的质量m(Na2CO3)= 0.1mol/L×0.5L×106g/mol=5.3g;
(2)用固体溶质配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签等,所以操作正确的顺序为:BCAFED;
(3)若转移溶液后,未洗涤烧杯和玻璃棒就直接定容,会使溶质的物质的量减少,结果导致配制的溶液的浓度偏低;
若定容时俯视刻度线,导致溶液体积偏小,使配制的溶液浓度偏高;
(4)加蒸馏水时不慎超过了刻度,实验失败且无法补救,因此必须倒掉溶液重新配制。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25°C时有关弱酸的电离平衡常数如下表:
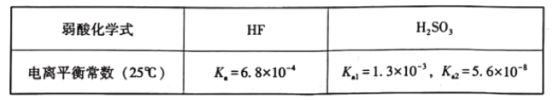
下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3)
B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁样品装入下图的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
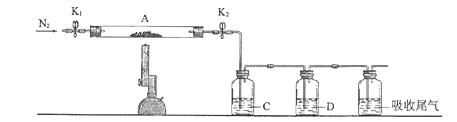
(1)C中的溶液为_______(填标号)。D中观察到的现象为___________。
a .品红 b .NaOH c. BaCl2 d. Ba(NO3)2 e. 浓H2SO4
(2)写出硫酸亚铁高温分解反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g) ![]() Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的平均摩尔质量保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于a kJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增加、正反应速率减少,平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=- lgKa, 25°C时,弱酸H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mo/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的曲线如下图所示。
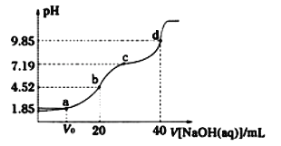
下列说法不正确的是
A.d点所得溶液中溶质的水解平衡常数Kh1=10-7.19
B.c点所得溶液中:c(Na+)+c(H+)= 2c(A2-)+ c(HA-)+ c(OH-)
C.b点所得溶液中: c(A2-)>c(H2A)
D.a点所得溶液中:溶质是NaHA和H2A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息:
I2 | 紫黑色晶体,沸点184.3°C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 |
CCl4 | 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 |
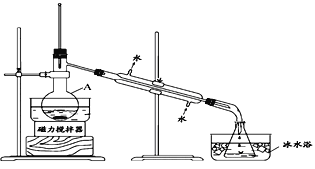
I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验:
(1)该装置中仪器A的名称是____________。
(2)锥形瓶置于冰水中的目的是_____________。
(3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。
①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏
II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验:
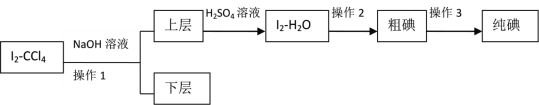
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名称是____________。
(5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。
(6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.5mol/L CuSO4溶液450mL和0.5mol/L硫酸溶液500mL,根据这两种溶液的配制情况回答下列问题:
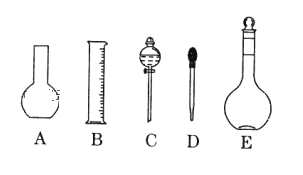
(1)如图所示的仪器中配制溶液肯定不需要的是 _____(填序号),配制上述 CuSO4溶液需用到的玻璃仪器除了烧杯、玻璃棒、量筒还有_______(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制CuSO4溶液时,如果用CuSO4固体,应该称量固体的质量为________;如果用CuSO4· 5H2O固体配制,应该称量固体的质量为__________。配制硫酸溶液时,需要取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__________。
(4)下列操作对溶液的浓度有何影响?(填“偏大”、“偏小”、“无影响”)
①没有对溶解固体时用到的烧杯洗涤_______________。
②使用前容量瓶用蒸馏水洗涤,且没有干燥_______________。
③配制的过程中有少量的液体迸溅出来_______________。
④定容时不小心加水过量,马上用胶头滴管吸出_______________。
⑤定容时俯视刻度线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com