
下列有关实验的选项正确的是
A记录滴定终点碱液读数为11.80mL | B.蒸干NaHCO3 饱和溶液制备NaHCO3晶体 | C.苯萃取碘水中I2,分出水层后的操作 | D. 观察Fe(OH)2的生成 |
|
|
|
|
A.A B.B C.C D.D
科目:高中化学 来源:2017届湖南省、衡阳八中等十三校重点中学高三第一次联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A. 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B. 将过量二氧化硫气体通人冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C. 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
D. 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:简答题
碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:简答题
雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
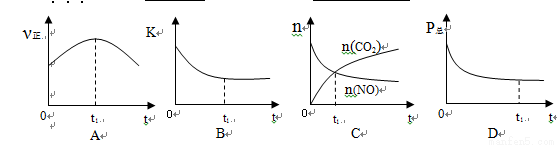
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
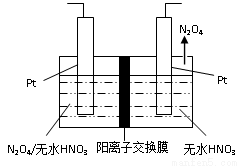
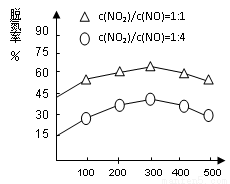
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。

(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____g•cm-3。 (图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:选择题
薄荷醇的结构简式如下图,下列说法正确的是
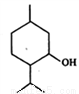
A. 薄荷醇属于芳香烃的含氧衍生物
B. 薄荷醇分子式为C10H20O,它是环己醇的同系物
C. 薄荷醇环上的一氯取代物只有三种
D. 在一定条件下,薄荷醇能与氢气、溴水反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:实验题
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
①铜屑与稀硝酸反应的化学反应方程式为 ;
②可能导致的两个不利因素是_____________、_________ _____。
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是___ _、__ _、过滤、晾干。
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
实验操作步骤 | 预期现象与结论 |
步骤1:观察样品 | 溶液呈蓝绿色,①_____(填“能”或“不能”)确定产物中铁元素的价态 |
步骤2:取少量溶液,滴加酸性KMnO4溶液 |
|
步骤3:③另取少量溶液,滴加KSCN溶 |
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g) 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com