
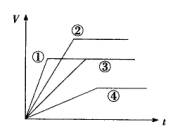
如下图所示,根据盐酸与足量大理石反应时间t和产生的二氧化碳体积V的关系图曲线,以下判断正确的是( )
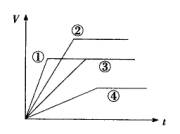
A.若温度相同,①反应的盐酸浓度大于③反应,但![]() 的物质的量相等
的物质的量相等
B.②反应中![]() 的物质的量浓度最大
的物质的量浓度最大
C.②与①的反应速率相等
D.反应速率由大到小的顺序为:①②③④
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:阅读理解
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.若温度相同,①反应的盐酸浓度大于③反应,但![]() 的物质的量相等
的物质的量相等
B.②反应中![]() 的物质的量浓度最大
的物质的量浓度最大
C.②与①的反应速率相等
D.反应速率由大到小的顺序为:①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南豫东、豫北十所名校高三阶段测试(四)理综化学试卷(解析版) 题型:填空题
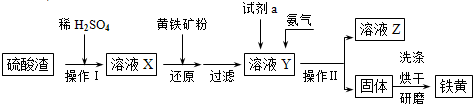
(15分)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
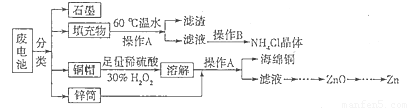
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
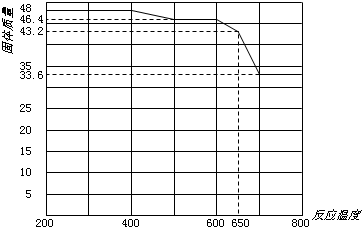
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
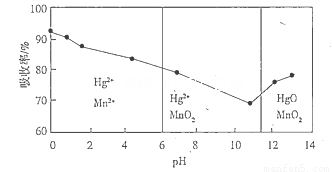
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
查看答案和解析>>
科目:高中化学 来源:2013届海南省高一下学期第二次月考化学试题(理科) 题型:实验题
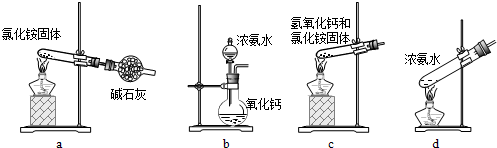
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下图所示:
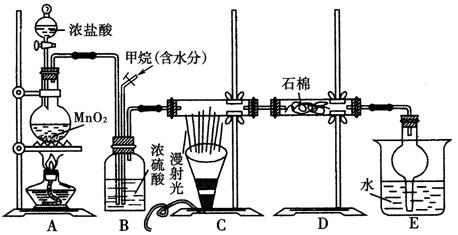
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应____________。
(3)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为____________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com